Ngày 29-8, họp xem xét cấp phép cho 2 loại vắc xin COVID-19, trong đó có Nano Covax
Thông tin của Tuổi Trẻ Online cho hay cả ngày mai 29-8, Hội đồng tư vấn cấp phép thuốc và vắc xin của Bộ Y tế sẽ họp xem xét 2 vắc xin COVID-19, trong đó có Nano Covax.
Vắc xin Nano Covax của Nanogen – Ảnh: DUYÊN PHAN
Theo đó, hội đồng gồm hơn 10 thành viên, gồm các chuyên gia về dịch tễ, lâm sàng, vắc xin, thuốc…, đứng đầu là PGS-TS Lê Văn Truyền – nguyên thứ trưởng Bộ Y tế, chuyên gia cao cấp về dược – sẽ dành cả ngày 29-8 họp xem xét hồ sơ 2 vắc xin, gồm 1 vắc xin nhập khẩu và 1 vắc xin trong nước. Trong đó, vắc xin trong nước là Nano Covax.
Thông tin ban đầu từ trước phiên họp, cho biết Hội đồng Đạo đức trong nghiên cứu y sinh quốc gia đã thông qua báo cáo thử nghiệm lâm sàng giữa kỳ giai đoạn 3a, điều kiện cần theo hướng dẫn mới, để có thể xem xét hồ sơ Nano Covax.
Cũng có ý kiến cho biết hồ sơ trình hội đồng xem xét trên báo cáo dữ liệu trước và sau tiêm 1.000 người tham gia thử nghiệm giai đoạn 3a, là con số “thấp hơn” so với các vắc xin đã được phê duyệt khẩn cấp sau thử nghiệm giai đoạn 3 trên thế giới.
Tuy nhiên, quyết định xem xét và có cho phép hay không sẽ do các hội đồng bàn bạc và đánh giá. Nếu nhận được kết quả đồng thuận, hội đồng sẽ có đề nghị gửi Bộ Y tế phê duyệt khẩn cấp cho các vắc xin này.
Video đang HOT
Cho đến nay, Nano Covax đã trải qua 3 giai đoạn thử nghiệm lâm sàng, với tổng số gần 14.000 người đã tiêm đủ 2 mũi, trong số này có 12.000 người tham gia giai đoạn 3b đang được theo dõi và lấy mẫu ngày 42 sau tiêm mũi 1, báo cáo chưa trình hội đồng lần này.
Báo cáo đánh giá giữa kỳ giai đoạn 3a trên 1.000 người thử nghiệm, trong đó 60% từ 18-45 tuổi, 22% từ 46-60 tuổi, số còn lại trên 60 tuổi. Trong đó, 3,45% có bệnh lý kèm theo (1 người có tiền sử ung thư, 3 người bệnh tim, 20 người tăng huyết áp, 60 người đái tháo đường…).
Kết quả cho thấy trung bình nồng độ kháng thể Anti-S-IgG đạt 57,56 U/ml, tăng gấp 218.93 lần so với D0 (trước khi tiêm), tỉ lệ chuyển đảo huyết thanh đạt 99,2%. Nhóm nghiên cứu đánh giá vắc xin đạt yêu cầu về tính sinh miễn dịch.
Về độ an toàn, sau tiêm vắc xin có 38,7% người thử nghiệm cho biết có đau nhẹ, 12% “đau trung bình”, 1 người đau nhiều tại vị trí tiêm, 2,6% có đỏ nhẹ tại vết tiêm, 5,4% có ngứa, 2,2% có sưng thành cục cứng tại vị trí tiêm, 2% có buồn nôn, 6,7% có đau cơ… Có 2 người gặp phản ứng phản vệ độ 2 và hồi phục trong ngày tiêm. Số còn lại bình thường.
Nhóm nghiên cứu đánh giá vắc xin đạt yêu cầu về sinh miễn dịch và độ an toàn. Hội đồng Đạo đức cũng đã thông qua kết luận này.
Ngoài Nano Covax, trong phiên họp ngày 29-8 sẽ xem xét hồ sơ 1 vắc xin nhập ngoại, là vắc xin Hayat-Vax sản xuất tại UAE (công nghệ mua của Hãng Sinopharm).
Bộ Y tế có thể cho đăng ký lưu hành vắc xin COVID-19 nội khẩn cấp trong 20 ngày
Trong hướng dẫn vừa ban hành ngày 19-8, Bộ Y tế có rất nhiều sửa đổi về quy chế đăng ký vắc xin, mở ra cơ hội đăng ký lưu hành các vắc xin ngừa COVID-19 nội địa và chuyển giao công nghệ.
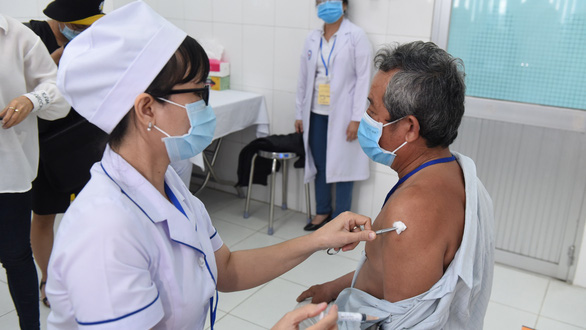
Tiêm Nano Covax cho người tình nguyện tham gia thử nghiệm lâm sàng giai đoạn 2 tại Long An - Ảnh: H.L.
Theo hướng dẫn này, vắc xin sản xuất trong nước đang thực hiện thử lâm sàng nhưng đã có kết quả đánh giá giữa kỳ giai đoạn 3 về tính an toàn, hiệu quả bảo vệ thì có thể xem xét cấp phép có điều kiện, trên cơ sở ý kiến của Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia.
Bên cạnh đó, Bộ Y tế cũng lấy ý kiến tư vấn của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc và tham khảo hướng dẫn của Tổ chức Y tế thế giới.
Vắc xin được cấp phép lưu hành có điều kiện được tiếp tục theo dõi về tính an toàn, hiệu quả, kiểm soát về số lượng, đối tượng, phạm vi sử dụng sau khi được cấp đăng ký lưu hành.
Trường hợp vắc xin đã được cấp phép lưu hành tại ít nhất một nước trên thế giới và có dữ liệu về tính an toàn, hiệu quả, vắc xin chuyển giao công nghệ tại Việt Nam và trước khi chuyển giao công nghệ có dữ liệu lâm sàng về tính an toàn, hiệu quả, được cấp phép tại ít nhất 1 nước trên thế giới có thể xem xét miễn 1 hoặc một số giai đoạn thử lâm sàng.
Nếu vắc xin đã được cấp phép nhưng cần đánh giá thêm về tính an toàn, hiệu quả thì phải thử nghiệm lâm sàng giai đoạn 4 tại Việt Nam.
Về thủ tục cấp giấy lưu hành vắc xin, Bộ Y tế hướng dẫn trong vòng 20 ngày làm việc kể từ khi nhận được đủ hồ sơ, Cục Quản lý dược sẽ cấp giấy phép đăng ký lưu hành vắc xin, trong trường hợp chưa cấp, cục sẽ phải thông báo rõ lý do.
Theo các quy định kể trên, hướng dẫn đăng ký lưu hành vắc xin khẩn cấp đã có nhiều điểm mới so với thông thường, trong đó thông thường vắc xin mới sẽ phải hoàn tất 3 giai đoạn thử nghiệm lâm sàng mới được xem xét cấp phép và phải chứng minh hiệu quả bảo vệ của vắc xin. Với hướng dẫn này, Bộ Y tế cho phép cấp phép sau khi có đánh giá giữa kỳ giai đoạn 3.
Về hiệu quả bảo vệ, cho phép dựa trên tính sinh miễn dịch của vắc xin để đáp ứng yêu cầu về thời gian trong tình hình chống dịch, do theo dõi hiệu quả bảo vệ của vắc xin cần có thời gian.
Tại Việt Nam hiện có 3 vắc xin đang thử nghiệm lâm sàng, gồm 2 vắc xin nội Nano Covax đã nộp báo cáo đánh giá giữa kỳ thử nghiệm lâm sàng giai đoạn 3 lên Bộ Y tế hôm nay 20-8; Covivac vừa bước vào thử nghiệm lâm sàng giai đoạn 2 và Arct-154 (vắc xin chuyển giao công nghệ) vừa bước vào thử nghiệm lâm sàng giai đoạn 1.
Trong trường hợp ứng viên vắc xin đạt yêu cầu về tính an toàn và tính sinh miễn dịch (qua đó đánh giá hiệu quả bảo vệ), Bộ Y tế có thể xem xét cấp phép trong điều kiện khẩn cấp.
Với Nano Covax, sau khi nhận báo cáo đánh giá giữa kỳ thử nghiệm lâm sàng giai đoạn 3, Bộ Y tế và Hội đồng đạo đức trong nghiên cứu y sinh sẽ họp nghiệm thu kết quả giữa kỳ, nếu đạt, nhà sản xuất sẽ nộp hồ sơ đăng ký vắc xin.
Với Covivac và Arct-154, dự kiến sẽ hoàn tất các thử nghiệm vào cuối năm và dự kiến sản xuất chính thức từ năm 2022.
Nghiên cứu cắt giảm thủ tục cấp phép khẩn cấp cho vaccine Nano Covax  Thủ tướng giao Bộ Y tế nghiên cứu, đề xuất theo thẩm quyền, bảo đảm quy trình chặt chẽ, an toàn, hiệu quả và rút gọn thủ tục hành chính về cấp phép khẩn cấp cho vaccine Nano Covax. Xét báo cáo và đề nghị của Công ty cổ phần Công nghệ sinh học Dược Nanogen về cấp phép khẩn cấp cho vaccine...
Thủ tướng giao Bộ Y tế nghiên cứu, đề xuất theo thẩm quyền, bảo đảm quy trình chặt chẽ, an toàn, hiệu quả và rút gọn thủ tục hành chính về cấp phép khẩn cấp cho vaccine Nano Covax. Xét báo cáo và đề nghị của Công ty cổ phần Công nghệ sinh học Dược Nanogen về cấp phép khẩn cấp cho vaccine...
 Cháy lớn tiệm spa ở TPHCM, 2 mẹ con leo mái tôn qua nhà hàng xóm thoát thân11:39
Cháy lớn tiệm spa ở TPHCM, 2 mẹ con leo mái tôn qua nhà hàng xóm thoát thân11:39 Nổ tàu chở dầu trên sông Bôi, 3 người bị thương00:52
Nổ tàu chở dầu trên sông Bôi, 3 người bị thương00:52 Khách Tây sốc khi lần đầu "đi bão" mừng đội tuyển Việt Nam vô địch AFF Cup01:33
Khách Tây sốc khi lần đầu "đi bão" mừng đội tuyển Việt Nam vô địch AFF Cup01:33 Người đàn ông trùm kín mít, bấm đèn đỏ khiến xe dừng không kịp ở TPHCM00:54
Người đàn ông trùm kín mít, bấm đèn đỏ khiến xe dừng không kịp ở TPHCM00:54 Người dân sợ bị phạt khi leo lề, rẽ phải nhường đường xe cấp cứu lúc bị kẹt xe09:12
Người dân sợ bị phạt khi leo lề, rẽ phải nhường đường xe cấp cứu lúc bị kẹt xe09:12 Vụ ô tô Mercedes lao xuống biển Nha Trang, xác định danh tính 4 cô gái đi cùng13:53
Vụ ô tô Mercedes lao xuống biển Nha Trang, xác định danh tính 4 cô gái đi cùng13:53 Vợ Quang Hải diện đồ 'áp lực' chồng trên sân cỏ, "đốt tiền" tỷ mua chuộc fan?02:48
Vợ Quang Hải diện đồ 'áp lực' chồng trên sân cỏ, "đốt tiền" tỷ mua chuộc fan?02:48 Phương Lê bị 'đội Youtuber' bênh Hồng Loan 'phá' việc làm ăn, 'chơi' pháp lý?03:26
Phương Lê bị 'đội Youtuber' bênh Hồng Loan 'phá' việc làm ăn, 'chơi' pháp lý?03:26 Hơn 130 giao lộ ở TP.HCM cho xe máy rẽ phải khi đèn đỏ08:48
Hơn 130 giao lộ ở TP.HCM cho xe máy rẽ phải khi đèn đỏ08:48 Luân 1927 ăn theo Lê Tuấn Khang từ A-Z, bà ngoại cũng 'nhái', dân mạng phẫn nộ?03:01
Luân 1927 ăn theo Lê Tuấn Khang từ A-Z, bà ngoại cũng 'nhái', dân mạng phẫn nộ?03:01 Phạt 'sập sàn', quái xế 'bốc hơi': Giao thông vào khuôn khổ, dân tình 'tấm tắc'!03:25
Phạt 'sập sàn', quái xế 'bốc hơi': Giao thông vào khuôn khổ, dân tình 'tấm tắc'!03:25Tiêu điểm
Tin đang nóng
Tin mới nhất

Cảnh sát giao thông bí mật ghi hình xử lý ô tô "rùa bò" ở Hà Nội

Nỗi đau xé lòng sau vụ tai nạn cướp đi 6 sinh mạng trong một gia đình ở Nghệ An

Sau tiếng nổ, khu xưởng tại Hà Nội bốc cháy ngùn ngụt

Hà Nội: Máy xúc va chạm với xe máy khiến 2 trẻ em tử vong

Người dân sợ bị phạt khi leo lề, rẽ phải nhường đường xe cấp cứu lúc bị kẹt xe

Long An: Đề nghị thanh tra toàn diện dự án công viên nghĩa trang Vĩnh Hằng

Hơn 130 giao lộ ở TP.HCM cho xe máy rẽ phải khi đèn đỏ

Giao xe cho tài xế có bằng lái hết hạn, chủ xe bị phạt 29 triệu đồng

2 cháu bé đuối nước tử vong khi chơi ở lòng hồ thủy điện

Nghị định 168 nâng tiền phạt giao thông: Vì sao ban hành 6 ngày đã áp dụng?

Hiện trường vụ xe tải lao vào quán tạp hóa, 6 người tử vong

Spa khám chữa bệnh không phép và chống người thi hành công vụ
Có thể bạn quan tâm

Ukraine phóng hơn 7.000 UAV vào Nga trong một năm
Thế giới
06:59:14 14/01/2025
Bắt 10 người, thu giữ 210kg pháo nổ ở TPHCM
Pháp luật
06:46:50 14/01/2025
Đi về miền có nắng - Tập 6: Hai mẹ con Vân yêu đơn phương hai bố con Phong
Phim việt
06:41:06 14/01/2025
Ý tưởng Xuân Son đá đội U23 tranh HCV SEA Games, "dùng dao mổ trâu giết gà"?
Sao thể thao
06:40:18 14/01/2025
Trấn Thành gây sốt MXH vì hành động đẹp tại WeChoice Awards 2024, chỉ một cái bắt tay mà được khen hết lời
Hậu trường phim
06:30:26 14/01/2025
Mỹ nhân hạng A bị mắng tơi tả khắp MXH: Hỗn láo với đàn chị, tính cách công chúa ai cũng chán ghét
Sao châu á
06:20:47 14/01/2025
Đang hì hụi lau nhà, chị dâu bất ngờ thưởng Tết cho tôi 20 triệu
Góc tâm tình
06:07:25 14/01/2025
Bữa sáng mỗi ngày ăn 1 trong 3 món này để bổ sung khí huyết, nuôi dưỡng làn da mịn đẹp, chống lạnh vào mùa đông
Ẩm thực
06:05:04 14/01/2025
Quyền Linh xót xa trước hoàn cảnh của mẹ đơn thân đến tham gia hẹn hò
Tv show
06:02:23 14/01/2025
Bài tập cho người mắc Hội chứng nghiện giật tóc
Sức khỏe
05:46:15 14/01/2025
 Thêm 42 người nghi nhiễm, Hà Nội tìm người đến chợ Ngọc Hà
Thêm 42 người nghi nhiễm, Hà Nội tìm người đến chợ Ngọc Hà Thanh Hóa ghi nhận thêm 14 ca mắc Covid-19 ngoài cộng đồng
Thanh Hóa ghi nhận thêm 14 ca mắc Covid-19 ngoài cộng đồng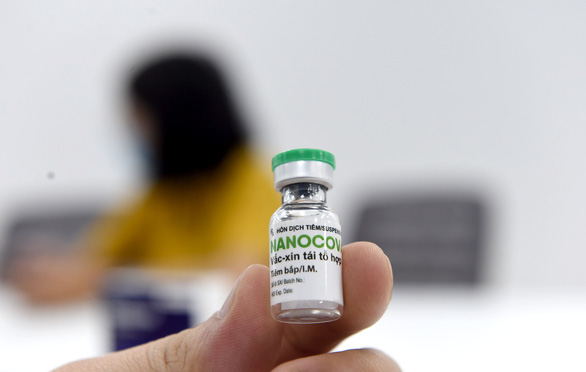
 Bình Dương nóng ruột xin tiêm vắc xin Nano Covax cho 200.000 công nhân
Bình Dương nóng ruột xin tiêm vắc xin Nano Covax cho 200.000 công nhân Vắc xin Nano Covax thử nghiệm trên 14.000 người, không ai có phản ứng nặng
Vắc xin Nano Covax thử nghiệm trên 14.000 người, không ai có phản ứng nặng Tiêm thử nghiệm lâm sàng vắc xin phòng COVID-19 của Việt Nam tại Hưng Yên
Tiêm thử nghiệm lâm sàng vắc xin phòng COVID-19 của Việt Nam tại Hưng Yên Bộ Y tế quyết định đẩy nhanh tốc độ thử nghiệm vaccine COVID-19 Nano Covax
Bộ Y tế quyết định đẩy nhanh tốc độ thử nghiệm vaccine COVID-19 Nano Covax Bị cho là 'nóng vội' khi xin cấp phép khẩn cho Nano Covax, Nanogen nói gì?
Bị cho là 'nóng vội' khi xin cấp phép khẩn cho Nano Covax, Nanogen nói gì? Đại diện Bộ Y tế: Kiến nghị cấp phép vắc xin Nano Covax là 'nóng vội, chưa đầy đủ dữ liệu khoa học'
Đại diện Bộ Y tế: Kiến nghị cấp phép vắc xin Nano Covax là 'nóng vội, chưa đầy đủ dữ liệu khoa học' Ô tô Mercedes chở nhiều người lao xuống biển Nha Trang
Ô tô Mercedes chở nhiều người lao xuống biển Nha Trang Xe tải tông vào cửa hàng tạp hóa làm 6 người tử vong
Xe tải tông vào cửa hàng tạp hóa làm 6 người tử vong Bình gas nổ trên bàn ăn, 9 học sinh và giáo viên bị bỏng ở Long An
Bình gas nổ trên bàn ăn, 9 học sinh và giáo viên bị bỏng ở Long An E dè bị xử phạt, đèn xanh còn 5 giây nhiều người đã dừng xe
E dè bị xử phạt, đèn xanh còn 5 giây nhiều người đã dừng xe Cục CSGT nói về thông tin liên quan đến Nghị định 168/2024
Cục CSGT nói về thông tin liên quan đến Nghị định 168/2024 Người đàn ông đi Mercedes rút kiếm đòi chém công nhân môi trường
Người đàn ông đi Mercedes rút kiếm đòi chém công nhân môi trường Cộng đồng mạng "lên đồng" với "đội săn phạt nguội", Công an TP HCM nói gì?
Cộng đồng mạng "lên đồng" với "đội săn phạt nguội", Công an TP HCM nói gì? Con gái riêng của chồng cũ Vũ Thu Phương tiếp tục gây xôn xao, sẽ đăng hình ảnh bằng chứng nếu không dừng 1 việc
Con gái riêng của chồng cũ Vũ Thu Phương tiếp tục gây xôn xao, sẽ đăng hình ảnh bằng chứng nếu không dừng 1 việc Ngôi sao Việt kiều "đặt vé" trở lại tuyển Việt Nam, HLV Kim Sang-sik đối mặt "cơn đau đầu dễ chịu"
Ngôi sao Việt kiều "đặt vé" trở lại tuyển Việt Nam, HLV Kim Sang-sik đối mặt "cơn đau đầu dễ chịu" Hoa hậu Phương Lê giao quyền điều hành công ty cho nghệ sĩ Vũ Luân
Hoa hậu Phương Lê giao quyền điều hành công ty cho nghệ sĩ Vũ Luân Tổng giám đốc đi Mercedes rút kiếm đe dọa công nhân môi trường đô thị bị bắt
Tổng giám đốc đi Mercedes rút kiếm đe dọa công nhân môi trường đô thị bị bắt Trà Ngọc tiết lộ mối quan hệ 'mẹ chồng nàng dâu' với NSƯT Kim Phương
Trà Ngọc tiết lộ mối quan hệ 'mẹ chồng nàng dâu' với NSƯT Kim Phương Phạm Quỳnh Anh bị chỉ trích chỉ vì 1 câu nói với Gil Lê
Phạm Quỳnh Anh bị chỉ trích chỉ vì 1 câu nói với Gil Lê "Công chúa bong bóng" đẹp nhất màn ảnh Hoa ngữ hiện tại: Nhan sắc lên hương dữ dội, tỏa sáng rực rỡ hậu Đêm Hội Weibo
"Công chúa bong bóng" đẹp nhất màn ảnh Hoa ngữ hiện tại: Nhan sắc lên hương dữ dội, tỏa sáng rực rỡ hậu Đêm Hội Weibo Cái giá phải trả của Triệu Lộ Tư
Cái giá phải trả của Triệu Lộ Tư Phú bà kín tiếng nhất hội bạn thân giàu có của Huyền Baby: 32 tuổi đã sở hữu Lamborghini 18 tỷ, cuộc sống hiện tại khiến nhiều người ao ước
Phú bà kín tiếng nhất hội bạn thân giàu có của Huyền Baby: 32 tuổi đã sở hữu Lamborghini 18 tỷ, cuộc sống hiện tại khiến nhiều người ao ước Màn lột xác ngoạn mục về nhan sắc của Ánh Viên, một khoảnh khắc gây chấn động giữa sự kiện
Màn lột xác ngoạn mục về nhan sắc của Ánh Viên, một khoảnh khắc gây chấn động giữa sự kiện Cặp đôi nhạc sĩ - diễn viên Vbiz khóa môi ngọt ngào hậu xác nhận yêu đương ngay đầu năm mới
Cặp đôi nhạc sĩ - diễn viên Vbiz khóa môi ngọt ngào hậu xác nhận yêu đương ngay đầu năm mới Duy Mạnh tiết lộ câu an ủi ngôi sao Thái Lan, nghe đã thấy đẳng cấp của đội trưởng tuyển Việt Nam
Duy Mạnh tiết lộ câu an ủi ngôi sao Thái Lan, nghe đã thấy đẳng cấp của đội trưởng tuyển Việt Nam Mỹ nhân hack tuổi thần sầu ở thảm đỏ WeChoice Awards 2024, sau 16 năm còn trẻ đẹp hơn thời mới vào nghề
Mỹ nhân hack tuổi thần sầu ở thảm đỏ WeChoice Awards 2024, sau 16 năm còn trẻ đẹp hơn thời mới vào nghề
 Jimmii Nguyễn: Thật xúc động khi nhạc sĩ Trần Tiến khen con gái 18 tuổi của tôi
Jimmii Nguyễn: Thật xúc động khi nhạc sĩ Trần Tiến khen con gái 18 tuổi của tôi
 Gã đàn ông mang 60 lít xăng đi đốt nhà bạn gái khiến 2 người chết
Gã đàn ông mang 60 lít xăng đi đốt nhà bạn gái khiến 2 người chết Dàn couple hot đổ bộ WeChoice 2024: Vợ chồng Trường Giang - Nhã Phương và nhà Đăng Khôi tình tứ, 1 cặp sắp cưới lần đầu lộ diện chung
Dàn couple hot đổ bộ WeChoice 2024: Vợ chồng Trường Giang - Nhã Phương và nhà Đăng Khôi tình tứ, 1 cặp sắp cưới lần đầu lộ diện chung