Nanogen báo cáo kết quả thử nghiệm lâm sàng Nano Covax với WHO
Đây là thông tin nằm trong hội thảo trực tuyến do WHO tổ chức giữa các học giả quốc tế về những vaccine Covid-19 triển vọng.
Tối 3/9 (theo giờ Việt Nam), ông Đỗ Minh Sĩ, Giám đốc Nghiên cứu và Phát triển, Công ty Cổ phần công nghệ sinh học Dược Nanogen, đã báo cáo kết quả thử nghiệm lâm sàng vaccine Covid-19 Nano Covax với Tổ chức Y tế Thế giới (WHO).
Nội dung này nằm trong hội thảo trực tuyến do WHO tổ chức, bàn luận về các vaccine Covid-19 mới với hơn 20 học giả, nhà nghiên cứu trên thế giới tham gia.
Tất cả tình nguyện viên thử nghiệm vaccine đều an toàn, khỏe mạnh
Đây là lần đầu tiên Nanogen báo cáo kết quả thử nghiệm lâm sàng với WHO. Tại buổi hội thảo, ông Đỗ Minh Sĩ cho biết Nano Covax sử dụng công nghệ protein tái tổ hợp, lấy trình tự một đoạn S protein gai trên nCoV, tích hợp nó vào một dòng tế bào động vật đang nuôi cấy để tạo ra protein của virus, rồi pha chế với các tá dược khác nhằm tạo ra vaccine.
Hiện tại, vaccine thử nghiệm lâm sàng với 4 liều là 25 mcg/ml, 50 mcg/ml, 75 mcg/ml và 100 mcg/ml.
Trong bản báo cáo với WHO và các học giả, đại diện Nanogen cho hay Nano Covax đã trải qua 3 giai đoạn thử nghiệm lâm sàng trên người. Trong đó, tổng số tình nguyện viên tham gia tiêm thử là 13.620 người, độ tuổi 18-50, sức khỏe bình thường.
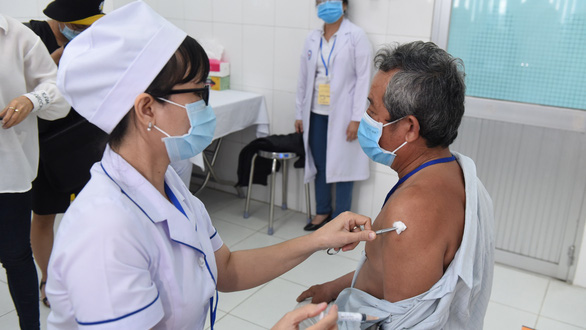
Ông Đỗ Minh Sĩ (bên trái, hàng trên), đại diện Nanogen trình bày kết quả thử nghiệm lâm sàng với WHO trong hội thảo tối 3/9. Ảnh chụp từ màn hình buổi hội thảo.
Riêng pha 3, số lượng tình nguyện viên tham gia tiêm thử là 13.000 người, chia làm 2 nhóm. Nhóm 1 gồm 1.000 tình nguyện viên, tỷ lệ tiêm giả dược là 6:1 (850 người tiêm Nano Covax, 150 người tiêm giả dược). Nhóm 2 gồm 12.000 người, tỷ lệ giả dược và vaccine là 2:1 (4.000 người tiêm giả dược, 8.000 người tiêm Nano Covax).
Ông Đỗ Minh Sĩ cho hay tất cả tình nguyện viên đều có sức khỏe ổn định, an toàn, vaccine có hiệu quả.
Video đang HOT
Tạo kháng thể trung hòa virus tốt
Trong bản trình bày, do thời gian có hạn (mỗi đại diện chỉ có 3-5 phút), ông Sĩ tập trung đưa các thông tin về giai đoạn 3 thử nghiệm lâm sàng trên người, cũng là giai đoạn có số mẫu tiêm thử nhiều nhất.
Ở pha 3, kết quả Nanogen đưa ra với các học giả, chuyên gia của WHO là tỷ lệ chuyển đổi huyết thanh (hàm lượng kháng thể Anti-S IgG, hoạt tính trung hòa virus) tại ngày 42 ở người tiêm vaccine Nano Covax (liều 25 mcg) là 99,2%. Ngoài ra, 0,8% tình nguyện viên không chuyển đổi huyết thanh. Ở nhóm giả dược, 100% người tiêm thử không chuyển đổi huyết thanh.
Ngoài ra, sau 42 ngày tiêm vaccine Covid-19, tỷ lệ người sinh phản ứng với protein tái tổ hợp của nCoV là 98,8%. Trong khi đó, con số ở nhóm người tiêm giả dược thấp hơn rất nhiều – 1,6%.
Bên cạnh đó, hiệu giá kháng thể trung hòa PNRT50 tại giai đoạn 2 và 3a tại các ngày 35, 42 và 90 của Nano Covax đều cao hơn so với nhóm hồi phục.
Theo ông Sĩ, việc đánh giá này dựa theo các hướng dẫn của WHO và tài liệu y văn thế giới. Căn cứ kết quả trên, Nano Covax 25 mcg có hiệu quả bảo vệ tương đương hoặc cao hơn so với nhóm hồi phục.
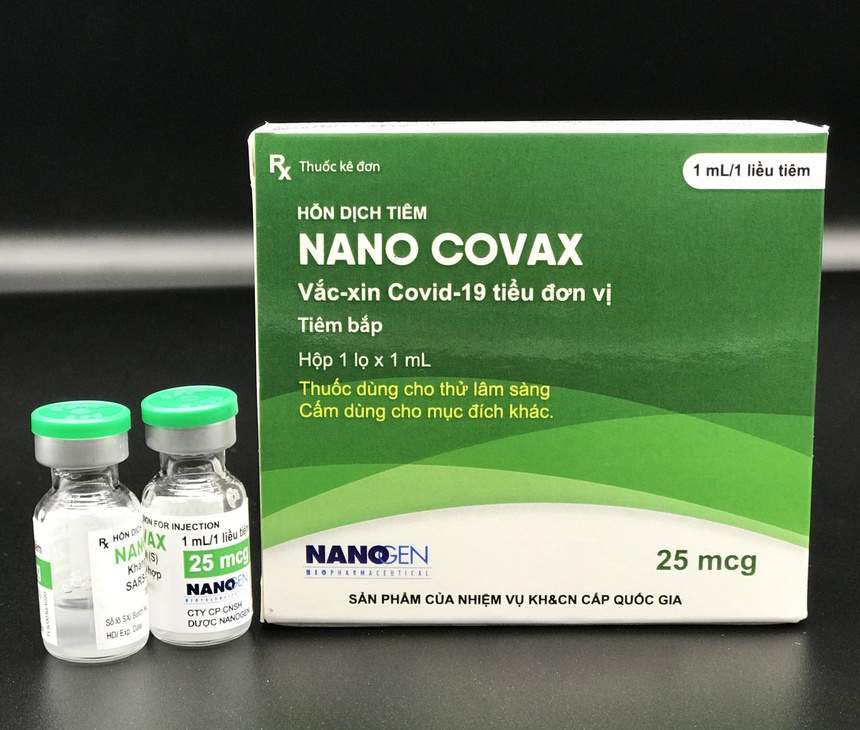
Vaccine Nano Covax đang thử nghiệm lâm sàng giai đoạn 3. Ảnh: Nanogen.
Với các biến chủng mới, hiệu giá kháng thể trung hòa PRNT50 trong nhóm giả dược không thay đổi tại ngày 42. Trong khi đó, nhóm tiêm Nano Covax 25 mcg đã tăng đáng kể, trên chủng Vũ Hán có 90,2% mẫu huyết thanh có khả năng trung hòa virus sống trên nuôi cấy tế bào từ 20 lần trở lên, tỷ lệ này ở chủng Delta là 62,2%. Nếu xét khả năng trung hòa từ 10 lần trở lên thì tỷ lệ này còn cao hơn.
Như vậy, tuy trung bình nhân hiệu giá kháng thể trung hòa với chủng Ấn Độ thấp hơn chủng Vũ Hán, tỷ lệ phần trăm có đáp ứng trung hòa với chủng Ấn Độ vẫn ở mức khá cao là 62,2%.
PRT50 được coi là “tiêu chuẩn vàng” để phát hiện và đo lường các kháng thể có khả năng vô hiệu hóa virus hay không. Trong phòng thí nghiệm, máu của người tiêm vaccine sẽ được pha loãng, trộn chung với virus sống để đánh giá hiệu quả bảo vệ của vaccine.
Trước đó, ngày 1/9, Công ty Cổ phần công nghệ sinh học Dược Nanogen gửi báo cáo giải trình các yêu cầu của Bộ Y tế liên quan hồ sơ xin cấp phép khẩn vaccine Nano Covax. Các thông tin được trình bày trong hội thảo với WHO giống với bản báo cáo giải trình Nanogen gửi Bộ Y tế.
Hiện tại, Nanogen là vaccine Covid-19 nội đầu tiên của Việt Nam hoàn thành thử nghiệm lâm sàng trên người pha 3. Trước đó, Nanogen đã gửi đơn xin Bộ Y tế cấp phép khẩn vaccine Nano Covax.
Hội đồng Đạo đức đã thông qua báo cáo giữa kỳ pha 3a vaccine Nano Covax. Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Hội đồng Cấp phép) và Hội đồng Đạo đức y sinh học quốc gia (Hội đồng Đạo đức), Bộ Y tế, đang xem xét hồ sơ của dược phẩm này trước khi cấp phép sử dụng khẩn cấp.
Nano Covax là vaccine ngừa Covid-19 do Việt Nam nghiên cứu và sản xuất. Trước khi đưa ra thử nghiệm lâm sàng, Nano Covax đã đạt tất cả chỉ tiêu tiền lâm sàng, được các cơ quan chức năng kiểm duyệt nghiêm ngặt. Mũi tiêm đầu tiên được thực hiện vào ngày 17/12/2020.
Giá bán của vaccine này chỉ khoảng 120.000 đồng/liều. Đến nay, công suất sản xuất của nhà máy ước đạt 8-12 triệu liều/tháng.
Dựa trên kế hoạch và năng lực hiện tại, công ty dự kiến đến tháng 12 năm nay có thể cung cấp đủ 50 triệu liều và 100 triệu liều vào năm 2022.
Bộ Y tế có thể cho đăng ký lưu hành vắc xin COVID-19 nội khẩn cấp trong 20 ngày
Trong hướng dẫn vừa ban hành ngày 19-8, Bộ Y tế có rất nhiều sửa đổi về quy chế đăng ký vắc xin, mở ra cơ hội đăng ký lưu hành các vắc xin ngừa COVID-19 nội địa và chuyển giao công nghệ.
Tiêm Nano Covax cho người tình nguyện tham gia thử nghiệm lâm sàng giai đoạn 2 tại Long An - Ảnh: H.L.
Theo hướng dẫn này, vắc xin sản xuất trong nước đang thực hiện thử lâm sàng nhưng đã có kết quả đánh giá giữa kỳ giai đoạn 3 về tính an toàn, hiệu quả bảo vệ thì có thể xem xét cấp phép có điều kiện, trên cơ sở ý kiến của Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia.
Bên cạnh đó, Bộ Y tế cũng lấy ý kiến tư vấn của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc và tham khảo hướng dẫn của Tổ chức Y tế thế giới.
Vắc xin được cấp phép lưu hành có điều kiện được tiếp tục theo dõi về tính an toàn, hiệu quả, kiểm soát về số lượng, đối tượng, phạm vi sử dụng sau khi được cấp đăng ký lưu hành.
Trường hợp vắc xin đã được cấp phép lưu hành tại ít nhất một nước trên thế giới và có dữ liệu về tính an toàn, hiệu quả, vắc xin chuyển giao công nghệ tại Việt Nam và trước khi chuyển giao công nghệ có dữ liệu lâm sàng về tính an toàn, hiệu quả, được cấp phép tại ít nhất 1 nước trên thế giới có thể xem xét miễn 1 hoặc một số giai đoạn thử lâm sàng.
Nếu vắc xin đã được cấp phép nhưng cần đánh giá thêm về tính an toàn, hiệu quả thì phải thử nghiệm lâm sàng giai đoạn 4 tại Việt Nam.
Về thủ tục cấp giấy lưu hành vắc xin, Bộ Y tế hướng dẫn trong vòng 20 ngày làm việc kể từ khi nhận được đủ hồ sơ, Cục Quản lý dược sẽ cấp giấy phép đăng ký lưu hành vắc xin, trong trường hợp chưa cấp, cục sẽ phải thông báo rõ lý do.
Theo các quy định kể trên, hướng dẫn đăng ký lưu hành vắc xin khẩn cấp đã có nhiều điểm mới so với thông thường, trong đó thông thường vắc xin mới sẽ phải hoàn tất 3 giai đoạn thử nghiệm lâm sàng mới được xem xét cấp phép và phải chứng minh hiệu quả bảo vệ của vắc xin. Với hướng dẫn này, Bộ Y tế cho phép cấp phép sau khi có đánh giá giữa kỳ giai đoạn 3.
Về hiệu quả bảo vệ, cho phép dựa trên tính sinh miễn dịch của vắc xin để đáp ứng yêu cầu về thời gian trong tình hình chống dịch, do theo dõi hiệu quả bảo vệ của vắc xin cần có thời gian.
Tại Việt Nam hiện có 3 vắc xin đang thử nghiệm lâm sàng, gồm 2 vắc xin nội Nano Covax đã nộp báo cáo đánh giá giữa kỳ thử nghiệm lâm sàng giai đoạn 3 lên Bộ Y tế hôm nay 20-8; Covivac vừa bước vào thử nghiệm lâm sàng giai đoạn 2 và Arct-154 (vắc xin chuyển giao công nghệ) vừa bước vào thử nghiệm lâm sàng giai đoạn 1.
Trong trường hợp ứng viên vắc xin đạt yêu cầu về tính an toàn và tính sinh miễn dịch (qua đó đánh giá hiệu quả bảo vệ), Bộ Y tế có thể xem xét cấp phép trong điều kiện khẩn cấp.
Với Nano Covax, sau khi nhận báo cáo đánh giá giữa kỳ thử nghiệm lâm sàng giai đoạn 3, Bộ Y tế và Hội đồng đạo đức trong nghiên cứu y sinh sẽ họp nghiệm thu kết quả giữa kỳ, nếu đạt, nhà sản xuất sẽ nộp hồ sơ đăng ký vắc xin.
Với Covivac và Arct-154, dự kiến sẽ hoàn tất các thử nghiệm vào cuối năm và dự kiến sản xuất chính thức từ năm 2022.
Tiêm thử nghiệm lâm sàng vắc xin phòng COVID-19 của Việt Nam tại Hưng Yên  Sáng 2/7, Học viện Quân y đã triển khai tiêm thử nghiệm đợt 2, giai đoạn 3 của vắc xin phòng COVID-19 Nano Covax của Việt Nam nghiên cứu và phát triển tại Hưng Yên. Vắc xin phòng COVID-19 Nano Covax do Công ty Nanogen nghiên cứu và phát triển, hiện đã bước sang giai đoạn 3 thử nghiệm lâm sàng. Đây là...
Sáng 2/7, Học viện Quân y đã triển khai tiêm thử nghiệm đợt 2, giai đoạn 3 của vắc xin phòng COVID-19 Nano Covax của Việt Nam nghiên cứu và phát triển tại Hưng Yên. Vắc xin phòng COVID-19 Nano Covax do Công ty Nanogen nghiên cứu và phát triển, hiện đã bước sang giai đoạn 3 thử nghiệm lâm sàng. Đây là...
 Vụ ô tô Mercedes lao xuống biển Nha Trang, xác định danh tính 4 cô gái đi cùng13:53
Vụ ô tô Mercedes lao xuống biển Nha Trang, xác định danh tính 4 cô gái đi cùng13:53 Người đàn ông trùm kín mít, bấm đèn đỏ khiến xe dừng không kịp ở TPHCM00:54
Người đàn ông trùm kín mít, bấm đèn đỏ khiến xe dừng không kịp ở TPHCM00:54 Người lạ vào tận trường mầm non nghi bắt cóc bé gái 4 tuổi10:53
Người lạ vào tận trường mầm non nghi bắt cóc bé gái 4 tuổi10:53 Xác minh người mặc đồ GrabBike chỉnh tín hiệu đèn giao thông ở TPHCM12:11
Xác minh người mặc đồ GrabBike chỉnh tín hiệu đèn giao thông ở TPHCM12:11 Người dân sợ bị phạt khi leo lề, rẽ phải nhường đường xe cấp cứu lúc bị kẹt xe09:12
Người dân sợ bị phạt khi leo lề, rẽ phải nhường đường xe cấp cứu lúc bị kẹt xe09:12 Vụ tin giả về Xuân Son: Việt Nam vô địch không cần anh, VFF 'dẹp' loạn MXH?03:02
Vụ tin giả về Xuân Son: Việt Nam vô địch không cần anh, VFF 'dẹp' loạn MXH?03:02 Hơn 130 giao lộ ở TP.HCM cho xe máy rẽ phải khi đèn đỏ08:48
Hơn 130 giao lộ ở TP.HCM cho xe máy rẽ phải khi đèn đỏ08:48 Vợ Xuân Son 'tức tốc' vào viện, nhận thông báo từ bác sĩ, làm 1 việc chạnh lòng?03:18
Vợ Xuân Son 'tức tốc' vào viện, nhận thông báo từ bác sĩ, làm 1 việc chạnh lòng?03:18 Dân "rén" phạt, TP.HCM kẹt xe cục bộ, xe cấp cứu "khóc thét" chờ đèn đỏ03:42
Dân "rén" phạt, TP.HCM kẹt xe cục bộ, xe cấp cứu "khóc thét" chờ đèn đỏ03:42 Madam Pang "phông bạt" gây phẫn nộ, CĐV Việt bị "dắt mũi" đau, VFF lên tiếng?02:56
Madam Pang "phông bạt" gây phẫn nộ, CĐV Việt bị "dắt mũi" đau, VFF lên tiếng?02:56 Hiện trường vụ xe tải lao vào quán tạp hóa, 6 người tử vong07:55
Hiện trường vụ xe tải lao vào quán tạp hóa, 6 người tử vong07:55Tiêu điểm
Tin đang nóng
Tin mới nhất

Điều tra vụ người đàn ông tử vong dưới mương nước

Tai nạn liên hoàn trên quốc lộ 1 qua Khánh Hòa, 13 người thương vong

Phát hiện nam bảo vệ tử vong tại trường học ở Nghệ An

Cháy nhà 3 tầng ở Hà Nội, 1 người mắc kẹt

Hà Nội: Điều tra nguyên nhân vụ cháy làm 2 người tử vong ở Phú Xuyên

Xe tang tông nhiều phương tiện dừng chờ đèn đỏ ở Nghệ An, 1 người tử vong

Một phụ nữ tử vong sau khi rơi từ tầng cao chung cư ở TP Vinh

Thi thể bé trai 7 tuổi mất tích được phát hiện dưới ao nước gần nhà

Phát hiện người đàn ông tử vong ở dốc cầu Phú Hữu, TP Thủ Đức

Xe tang lao vào đám đông chờ đèn đỏ, 1 người tử vong, 2 người bị thương

Tới dự đám cưới, ô tô do người đàn ông điều khiển bất ngờ lao xuống hồ Cô Tiên

Xe container lao vào cabin trạm thu phí cao tốc Diễn Châu - Bãi Vọt
Có thể bạn quan tâm

Tổng thống Mỹ Donald Trump chỉ định quyền Bộ trưởng Quốc phòng
Thế giới
16:56:49 21/01/2025
Phim Trung Quốc gây bão toàn cõi mạng với 10 tỷ lượt xem, nữ chính đẹp như tiên tử hạ phàm
Phim châu á
16:33:52 21/01/2025
Song Hye Kyo bị miệt thị ngoại hình
Hậu trường phim
16:30:40 21/01/2025
Bức ảnh xấu hổ mà Ronaldo "không bao giờ muốn nhìn lại"
Sao thể thao
16:17:57 21/01/2025
Hôm nay nấu gì: Bữa tối có món canh chua ngon lại giàu dinh dưỡng, ai ăn cũng thích
Ẩm thực
16:16:53 21/01/2025
Hot nhất MXH: Phơi bày bí mật kẻ đâm sau lưng Angelababy, Dương Mịch và 2 cái tên gây sốc vào tầm ngắm
Sao châu á
16:14:03 21/01/2025
Cái kết tệ của "doanh nhân rút kiếm"
Pháp luật
15:16:40 21/01/2025
Á hậu Vbiz có động thái cực phũ với "tình tin đồn" hậu lùm xùm lợi dụng, phản ứng của đàng trai gây ngỡ ngàng
Sao việt
15:12:59 21/01/2025
Xuân Son 3 lần thay đổi kiểu tóc độc lạ khiến dân tình bất ngờ, từ chàng trai tóc xù đến quý ông lịch lãm
Netizen
15:03:15 21/01/2025
 Giải pháp chống dịch Covid-19 tại bệnh viện tâm thần
Giải pháp chống dịch Covid-19 tại bệnh viện tâm thần Ngày 3/9, Hà Nội diễn biến nóng, phân thành 3 vùng để tăng cường chống dịch
Ngày 3/9, Hà Nội diễn biến nóng, phân thành 3 vùng để tăng cường chống dịch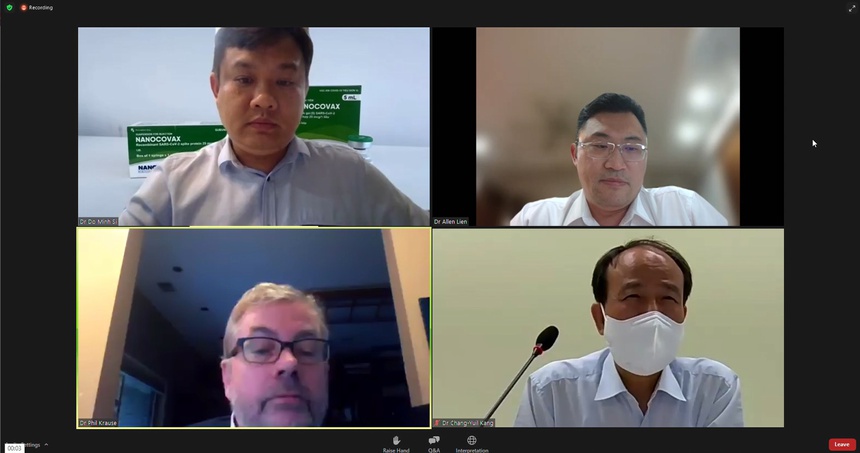
 Bộ Y tế quyết định đẩy nhanh tốc độ thử nghiệm vaccine COVID-19 Nano Covax
Bộ Y tế quyết định đẩy nhanh tốc độ thử nghiệm vaccine COVID-19 Nano Covax Bị cho là 'nóng vội' khi xin cấp phép khẩn cho Nano Covax, Nanogen nói gì?
Bị cho là 'nóng vội' khi xin cấp phép khẩn cho Nano Covax, Nanogen nói gì? Nanogen báo cáo dữ liệu vô hiệu hóa biến thể Delta của vắc xin Nanocovax
Nanogen báo cáo dữ liệu vô hiệu hóa biến thể Delta của vắc xin Nanocovax Vụ tử vong vì không được cấp cứu: Định danh vi phạm của 6 cơ sở y tế
Vụ tử vong vì không được cấp cứu: Định danh vi phạm của 6 cơ sở y tế Nếu được cấp phép, vắc xin Nano Covax sẽ được dùng ra sao?
Nếu được cấp phép, vắc xin Nano Covax sẽ được dùng ra sao? WHO tặng Việt Nam trang thiết bị y tế hơn 400.000 USD
WHO tặng Việt Nam trang thiết bị y tế hơn 400.000 USD Tai nạn trên cao tốc Đà Nẵng - Quảng Ngãi, tài xế mắc kẹt trong cabin
Tai nạn trên cao tốc Đà Nẵng - Quảng Ngãi, tài xế mắc kẹt trong cabin Tai nạn liên hoàn ở Mộc Châu, xe khách biến dạng
Tai nạn liên hoàn ở Mộc Châu, xe khách biến dạng Cháy lớn căn nhà 5 tầng bán máy hàn ở TPHCM
Cháy lớn căn nhà 5 tầng bán máy hàn ở TPHCM Xác minh clip tài xế xe khách bị chặn đánh trên quốc lộ 18
Xác minh clip tài xế xe khách bị chặn đánh trên quốc lộ 18 Xe container lao vào trạm thu phí: Tài xế có phải đền bù?
Xe container lao vào trạm thu phí: Tài xế có phải đền bù? Bé trai 3 tuổi mất tích ở Tiền Giang đã tử vong do đuối nước
Bé trai 3 tuổi mất tích ở Tiền Giang đã tử vong do đuối nước Đình chỉ 3 nhân viên đường sắt chậm kéo gác chắn
Đình chỉ 3 nhân viên đường sắt chậm kéo gác chắn Tiền Giang: Xe tải bốc cháy đang lưu thông trên đường cao tốc
Tiền Giang: Xe tải bốc cháy đang lưu thông trên đường cao tốc Ngày cuối năm trong bệnh viện, 9 người đàn ông túm tụm trước phòng cấp cứu: Người dưng nghe chuyện mà rưng rưng
Ngày cuối năm trong bệnh viện, 9 người đàn ông túm tụm trước phòng cấp cứu: Người dưng nghe chuyện mà rưng rưng "Tiểu công chúa Nhà Trắng" xuất hiện: Con gái 13 tuổi của Ivanka Trump gây sốt với vẻ đẹp thiên thần trong lễ nhậm chức của ông ngoại
"Tiểu công chúa Nhà Trắng" xuất hiện: Con gái 13 tuổi của Ivanka Trump gây sốt với vẻ đẹp thiên thần trong lễ nhậm chức của ông ngoại Các thông tin xoay quanh concert của Jack trong năm 2025 đã âm thầm bị gỡ bỏ
Các thông tin xoay quanh concert của Jack trong năm 2025 đã âm thầm bị gỡ bỏ Tổng thống Donald Trump rút Mỹ khỏi WHO
Tổng thống Donald Trump rút Mỹ khỏi WHO Ông Trump ký sắc lệnh hoãn lệnh cấm TikTok 75 ngày
Ông Trump ký sắc lệnh hoãn lệnh cấm TikTok 75 ngày Nghi vấn chàng trai tự thiêu bên ngoài hôn trường của người yêu cũ
Nghi vấn chàng trai tự thiêu bên ngoài hôn trường của người yêu cũ Mẹ chồng đưa 600 nghìn bảo tôi sắm Tết cho cả nhà 4 người
Mẹ chồng đưa 600 nghìn bảo tôi sắm Tết cho cả nhà 4 người Chuyện gì đang xảy ra với "bạn gái tin đồn" của HIEUTHUHAI?
Chuyện gì đang xảy ra với "bạn gái tin đồn" của HIEUTHUHAI? Mẹ nuôi K-ICM tiết lộ Thiên An bị phạt 500 triệu đồng, khẳng định còn nhiều chuyện động trời liên quan đến 1 "nghệ sĩ"
Mẹ nuôi K-ICM tiết lộ Thiên An bị phạt 500 triệu đồng, khẳng định còn nhiều chuyện động trời liên quan đến 1 "nghệ sĩ" Chó pitbull cắn tử vong bé trai 8 tuổi, nhân chứng cố giải cứu trong tuyệt vọng: Hiện trường gây ám ảnh!
Chó pitbull cắn tử vong bé trai 8 tuổi, nhân chứng cố giải cứu trong tuyệt vọng: Hiện trường gây ám ảnh! Mẹ bỏ đi, bố bị tâm thần bỗng một ngày đưa về nhà đứa em "nhặt được", người con trai rơi vào khó xử - Cú ngoặt thế kỷ xảy ra!
Mẹ bỏ đi, bố bị tâm thần bỗng một ngày đưa về nhà đứa em "nhặt được", người con trai rơi vào khó xử - Cú ngoặt thế kỷ xảy ra! Hà Phương đọ sắc cùng Minh Tuyết, tiết lộ kế hoạch đón tết ở Việt Nam
Hà Phương đọ sắc cùng Minh Tuyết, tiết lộ kế hoạch đón tết ở Việt Nam Diễn viên Diệu Hương trang hoàng biệt thự ở Mỹ đón Tết
Diễn viên Diệu Hương trang hoàng biệt thự ở Mỹ đón Tết Thiên An âm thầm chịu nợ nần, chi tiết số dư tài khoản thật gây sốc
Thiên An âm thầm chịu nợ nần, chi tiết số dư tài khoản thật gây sốc Sao nam hot nhất lúc này: Được Trấn Thành o bế, vướng tin đồn yêu Tiểu Vy
Sao nam hot nhất lúc này: Được Trấn Thành o bế, vướng tin đồn yêu Tiểu Vy 5 á hậu thi Hoa hậu Quốc tế đều lấy chồng có gia thế 'khủng' là ai?
5 á hậu thi Hoa hậu Quốc tế đều lấy chồng có gia thế 'khủng' là ai? Nữ tỷ phú Madam Pang hiếm hoi lộ diện với chồng đại tá cảnh sát, cuộc sống "dát vàng" khiến ai cũng mơ ước
Nữ tỷ phú Madam Pang hiếm hoi lộ diện với chồng đại tá cảnh sát, cuộc sống "dát vàng" khiến ai cũng mơ ước MC Mai Ngọc xinh đẹp bên hoa thược dược, Hồng Đăng cùng vợ con du xuân sớm
MC Mai Ngọc xinh đẹp bên hoa thược dược, Hồng Đăng cùng vợ con du xuân sớm