Những điểm mới quy định ghi nhãn thuốc, nguyên liệu làm thuốc
Cục Quản lý Dược (Bộ Y tế) cho biết, Bộ Y tế đã ban hành Thông tư số 01/2018/TT-BYT ngày 18/01/2018 của Bộ trưởng Bộ Y tế quy định ghi nhãn thuốc, nguyên liệu làm thuốc và tờ hướng dẫn sử dụng thuốc thay thế Thông tư số 06/2016/TT-BYT ngày 08/03/2016 của Bộ Y tế về nội dung này trước đó.
Theo đó đã sửa đổi, bổ sung một số thuật ngữ mới được điều chỉnh trong Luật dược như: thuốc cổ truyền thay cho thuốc đông y, thuốc dược liệu thay cho thuốc từ dược liệu; bổ sung và quy định nội dung ghi nhãn của thuốc pha chế theo đơn và bán tại nhà thuốc, thuốc bào chế và sản xuất trong các cơ sở khám bệnh, chữa bệnh để thống nhất các nội dung ghi nhãn đối với các thuốc lưu hành trên thị trường mà không yêu cầu phải cấp giấy đăng ký lưu hành.
Cục Quản lý Dược cho rằng quy định ghi nhãn đối với các thuốc sản xuất, pha chế trong bệnh viện góp phần tích cực trong việc cung cấp đầy đủ thông tin sử dụng thuốc cho cán bộ y tế và giúp cho người bệnh hiểu rõ lợi ích và tác hại của thuốc, tuân thủ đúng hướng dẫn điều trị, đảm bảo sử dụng thuốc hợp lý và an toàn.
Ghi một số dấu hiệu nhận biết trên nhãn và tờ hướng dẫn sử dụng thuốc đối với một số loại thuốc, nguyên liệu làm thuốc như: thuốc độc, thuốc phóng xạ, nguyên liệu độc, nguyên liệu phóng xạ, dược liệu độc. Các lưu ý về nguyên liệu phải kiểm soát đặc biệt phải được in đậm trong khung và được in trên mặt chính của nhãn có ghi tên nguyên liệu; các lưu ý về thuốc độc, thuốc phóng xạ phải được in đậm theo kiểu chữ in hoa trên nhãn và tờ hướng dẫn sử dụng thuốc.
Việc quy định phải in các dấu hiệu lưu ý đối với nguyên liệu làm thuốc phải kiểm soát đặc biệt, thuốc độc, thuốc phóng xạ nhằm mục đích cảnh báo nguy cơ dùng nhầm thuốc, nguyên liệu làm thuốc, lưu ý đặc biệt khi bảo quản, vận chuyển và sử dụng thuốc cho người bệnh, cung cấp đầy đủ thông tin cho cho nhân viên y tế trong quá trình kê đơn, hướng dẫn sử dụng thuốc cho bệnh nhân được an toàn, hiệu quả.
Trước đây các quy định về nguyên tắc đặt tên thương mại của thuốc được quy định trong thông tư đăng ký thuốc. Tuy nhiên nội dung quy định này đã được bổ sung và quy định trong thông tư ghi nhãn, trong đó đã sửa đổi quy định “không được đặt tên thuốc khác nhau trong trường hợp thuốc có cùng tất cả các tiêu chí sau: hoạt chất, dược liệu, dạng bào chế, đường dùng, nồng độ, hàm lượng và nhà sản xuất”.
Video đang HOT
Nội dung quy định mới này đã khắc phục được tình trạng doanh nghiệp đặt nhiều tên thuốc khác nhau mặc dù thuốc có cùng các tiêu chí về dạng bào chế, đường dùng, nồng độ, hàm lượng và nhà sản xuất nhưng có công thức bào chế khác nhau, chỉ khác nhau thành phần tá dược.
Nhằm phục vụ công tác quản lý, kiểm tra, thanh tra hoạt động kinh doanh dược đối với hoạt động thay thế, bổ sung tờ hướng dẫn sử dụng bằng tiếng Việt tại Việt Nam, thông tư đã bổ sung quy định cụ thể hơn các trường hợp được bổ sung nhãn phụ, thay thế, bổ sung tờ hướng dẫn sử dụng bằng tiếng Việt tại Việt Nam và có yêu cầu cơ sở phải báo cáo về Bộ Y tế trong thời hạn một tháng kể từ thời điểm kết thúc thực hiện việc bổ sung hoặc thay thế tờ hướng dẫn sử dụng thuốc tại Việt Nam.
Hiện nay, thuốc lưu hành trên thị trường trong bao bì thương phẩm phải có tờ hướng dẫn sử dụng thuốc bằng tiếng Việt trong đó được trình bày thành 2 phần, là hướng dẫn sử dụng thuốc cho cán bộ y tế và hướng dẫn sử dụng thuốc cho người bệnh. Hai phần hướng dẫn sử dụng thuốc này có nhiều nội dung trùng lắp với nhau, hơn nữa việc quy định 2 phần hướng dẫn trong bao bì thuốc sẽ làm tăng kích thước của hộp thuốc và tăng chi phí sản xuất do phải in thêm nội dung tờ hướng dẫn sử dụng. Để khắc phục tồn tại và khó khăn trên cho doanh nghiệp, Thông tư mới đã bổ sung và bỏ quy định tờ hướng dẫn sử dụng thuốc gồm hai phần nêu trên và bỏ phần hướng dẫn sử dụng thuốc cho người bệnh.
Thông tư đã bổ sung quy định về thời gian công bố tờ hướng dẫn sử dụng thuốc biệt dược gốc, sinh phẩm tham chiếu đã được cấp giấy đăng ký lưu hành tại Việt Nam trên Website của Cục Quản lý Dược. Đồng thời quy định trách nhiệm của cơ sở sản xuất, đăng ký thuốc generic, sinh phẩm tương tự phải tham khảo trong quá trình chuẩn bị tờ hướng dẫn sử dụng thuốc hoặc cập nhật nội dung tờ hướng dẫn sử dụng thuốc generic, sinh phẩm tương tự phù hợp với tờ hướng dẫn sử dụng của thuốc biệt dược gốc, sinh phẩm tham chiếu tương ứng với nồng độ, hàm lượng, hoạt chất, dạng bào chế, đường dùng của thuốc trong quá trình lưu hành.
Việc quy định này nhằm đảm bảo và từng bước thống nhất, đồng bộ các thông tin sử dụng thuốc của các thuốc generic, sinh phẩm tương tự đã được cấp phép lưu hành tại Việt Nam theo các thông tin hướng dẫn sử dụng thuốc của thuốc biệt dược gốc, sinh phẩm tham chiếu tương ứng trên cơ sở hồ sơ lâm sàng và tờ hướng dẫn sử dụng của các thuốc này đã được chuẩn hóa, phê duyệt và cấp phép lưu hành tại Việt Nam.
Ngoài ra, để tạo điều kiện thuận lợi và nâng cao trách nhiệm của doanh nghiệp, thông tư còn quy định cụ thể một số trường hợp, cơ sở sản xuất, đăng ký, nhập khẩu thuốc được phép ghi thêm một số nội dung khác trên nhãn, tờ hướng dẫn sử dụng thuốc ngoài các nội dung bắt buộc theo quy định của Thông tư, các nội dung ghi thêm này, cơ sở không phải thông báo và không cần có sự phê duyệt của Bộ Y tế, tuy cơ sở phải tự chịu trách nhiệm về tính chính xác của các thông tin ghi thêm.
Tú Anh
Theo Dân trí
Sẽ tăng cường hậu kiểm trong lĩnh vực trang thiết bị y tế
Ông Nguyễn Minh Tuấn, Vụ trưởng Vụ Trang thiết bị và Công trình y tế (Bộ Y tế) cho biết hiện cơ quan này đang đề xuất bãi bỏ, sửa đổi nhiều điều kiện liên quan tới việc sản xuất, kinh doanh thiết bị y tế nhằm tạo thuận lợi cho doanh nghiệp. Bên cạnh đó đẩy mạnh hậu kiểm để giải phóng thời gian lưu khó máy móc của các đơn vị.
Tại Hội nghị đánh giá sau 2 năm thực hiện, triển khai Nghị định 36/2016/NĐ-CP về quản lý trang thiết bị y tế và lấy ý kiến về các nội dung của Dự thảo Nghị định sửa đổi Nghị định 36/2016/NĐ-CP về quản lý trang thiết bị y tế, ông Tuấn cho biết thời gian qua việc giải quyết đối với các thủ tục hành chính được thực hiện nhanh chóng, thuận lợi cho công tác xử lý, theo dõi và quản lý thông tin hồ sơ, các DN do toàn bộ công việc được xử lý trên phần mềm hệ thống trực tuyến và theo mức độ 4 về công nghệ thông tin.
Tuy nhiên, do số lượng văn bản quy phạm pháp luật có liên quan đến trang thiết bị y tế lớn, nhiều nội dung khó mang đậm tính đặc thù, phức tạp, thường xuyên được thay đổi và có nhiều nội dung giáp ranh, liên quan đến nhiều lĩnh vực của các Bộ, ngành khác... trong khi nhân lực còn thiếu cũng ảnh hưởng đến tiến độ công việc.
Ông Tuấn chia sẻ, nhân lực theo dõi lĩnh vực thiết bị y tế của Vụ chỉ có 11 người, bao gồm cả lãnh đạo phụ trách nhưng mỗi năm phải thụ lý từ 4.500 - 7.000 hồ sơ về quản lý nhập khẩu thiết bị y tế.
Thời gian qua, Bộ Y tế đã triển khai 6 nhóm thủ tục công bố, đăng ký, đề nghị cấp phép trực tuyến tại Bộ Y tế (giai đoạn 1 từ ngày 1/1/2017: công bố đủ điều kiện phân loại thiết bị y tế và giai đoạn 2 từ ngày 1/7/2017 với 5 nhóm thủ tục theo Nghị định 36/2016/NĐ-CP để tạo điều kiện tốt nhất cho các doanh nghiệp.
Đến nay, theo báo cáo của các Sở Y tế và theo dõi trên hệ thống dịch vụ công trực tuyến quản lý thiết bị y tế, các cơ sở đã tiếp nhận, giải quyết và trả kết quả 10.462 hồ sơ của doanh nghiệp, trong đó số lượng hồ sơ đã thực hiện công bố là 10.327.
Ông Tuấn cũng cho biết thêm, hiện Bộ Y tế đang đề xuất sửa đổi nghị định 36 theo hướng tạo điều kiện tối đa cho doanh nghiệp. Theo đó bãi bỏ 11 điều kiện sản xuất, kinh doanh và sửa đổi 24 điều kiện sản xuất, kinh doanh thiết bị y tế. Bên cạnh đó, Bộ Y tế đang phối hợp với Tổng cục Hải quan, Bộ Tài chính xây dựng Dự thảo Thông tư ban hành Danh mục trang thiết bị y tế kém theo mã số HS theo danh mục hàng hóa xuất khẩu, nhập khẩu, thuộc diện quản lý chuyên ngành của Bộ Y tế.
"Khi đã thoáng về thủ tục cho doanh nghiệp, việc hậu kiểm sẽ được trung tâm kiểm chuẩn giám sát thực hiện. Tuy nhiên, hiện nay hệ thống này còn yếu phải tiếp tục được đẩy mạnh. Bản thân bệnh viên khi đấu thầu, mua sắm cũng cần có trách nhiệm kiểm tra và hậu kiểm khi đã lắp đặt, sử dụng", ông Tuấn nói.
Tại Hội nghị, các chuyên gia cũng cho biết thời gian qua cũng có những doanh nghiệp lợi dụng nhằm qua mặt các cơ quan chức năng để kinh doanh thiết bị y tế chưa đảm bảo chất lượng, Ví như các hình thức tạm xuất tái nhập, phá niêm phong, đánh tráo hàng ngay trên đường vận chuyển, thẩm lậu vào nội địa để tiêu thụ hoặc hàng vận chuyển đến Campuchia rồi tìm cách quay ngược Việt Nam... là những thủ đoạn gian lận thương mại mới trong lĩnh vực thiết bị y tế, đòi hỏi sự vào cuộc ráo riết hơn của cơ quan Hải quan để ngăn chặn những nguy cơ này.
Hồng Hải
Theo Dân trí
Bạn gái đòi chia tay sau nhiều lần cho tôi cơ hội sửa đổi  Tôi phải làm sao để hình ảnh của mình tốt lên trong mắt em? 4 năm biết bao nhiêu kỷ niệm vui buồn, tôi vẫn muốn đi tiếp cùng em. Tôi và bạn gái yêu nhau được 4 năm, từ năm học chung cấp 3. Giờ em học đại học năm thứ 3, còn tôi đi nghĩa vụ 2 năm, về em vẫn...
Tôi phải làm sao để hình ảnh của mình tốt lên trong mắt em? 4 năm biết bao nhiêu kỷ niệm vui buồn, tôi vẫn muốn đi tiếp cùng em. Tôi và bạn gái yêu nhau được 4 năm, từ năm học chung cấp 3. Giờ em học đại học năm thứ 3, còn tôi đi nghĩa vụ 2 năm, về em vẫn...
 Thanh niên quê Hà Nội 'bắt cá 2 tay' đánh gục bạn gái ở quán cà phê sắp hầu tòa01:27
Thanh niên quê Hà Nội 'bắt cá 2 tay' đánh gục bạn gái ở quán cà phê sắp hầu tòa01:27 Bắt giữ khẩn cấp đối tượng đánh người nước ngoài trên phố Bùi Viện01:43
Bắt giữ khẩn cấp đối tượng đánh người nước ngoài trên phố Bùi Viện01:43 Sạt lở đất vùi lấp căn nhà ở Sa Pa, người phụ nữ tử vong08:16
Sạt lở đất vùi lấp căn nhà ở Sa Pa, người phụ nữ tử vong08:16 Nga điều tiêm kích Su-35 cản trở Estonia bắt giữ tàu dầu?09:27
Nga điều tiêm kích Su-35 cản trở Estonia bắt giữ tàu dầu?09:27 Đến Trung Đông, ông Trump hứa Mỹ không còn 'rao giảng về cách sống'09:21
Đến Trung Đông, ông Trump hứa Mỹ không còn 'rao giảng về cách sống'09:21 Đè vạch chờ đèn đỏ cũng bị phạt 20 triệu là quá nặng?09:35
Đè vạch chờ đèn đỏ cũng bị phạt 20 triệu là quá nặng?09:35 Ấn Độ khánh thành cơ sở sản xuất tên lửa BrahMos09:57
Ấn Độ khánh thành cơ sở sản xuất tên lửa BrahMos09:57 Trung Quốc công bố sách trắng về an ninh quốc gia trong thời đại mới09:17
Trung Quốc công bố sách trắng về an ninh quốc gia trong thời đại mới09:17 Malaysia tìm giải pháp sau khi voi con bị xe tông chết vì băng ngang xa lộ01:22
Malaysia tìm giải pháp sau khi voi con bị xe tông chết vì băng ngang xa lộ01:22 Khi thương chiến Mỹ - Trung hạ nhiệt09:43
Khi thương chiến Mỹ - Trung hạ nhiệt09:43 Tổng thống Trump đến nhóm nước giàu nhất Vùng Vịnh08:05
Tổng thống Trump đến nhóm nước giàu nhất Vùng Vịnh08:05Tiêu điểm
Tin đang nóng
Tin mới nhất

Hà Nội thúc đẩy ứng dụng trí tuệ nhân tạo trong lĩnh vực y tế

Điều gì xảy ra với cột sống cổ khi sinh hoạt sai tư thế
Triệu chứng báo hiệu bị cường giáp

'Hậu sởi gây mất trí nhớ miễn dịch' là gì?

CDC Mỹ khuyến cáo tiêm ngừa phế cầu từ 50 tuổi để phòng biến chứng nặng

Đường dây khí cười bị triệt phá, bác sĩ cảnh báo tổn thương thần kinh

Mùa hè nắng nóng người tăng huyết áp cần đặc biệt chú ý đến điều này

Tại sao không nên dùng nước sôi 100 độ C để pha trà xanh?

Chuyên gia tâm lý: Nỗi đau dẫn đến tự tử nằm ở "vết nứt" của đời sống
Não biến đổi ra sao sau 3 ngày bạn không nói chuyện với ai?

Giữa cơn bão AI, người thầy vẫn là trái tim của giáo dục

AI và y học: Khi trí tuệ nhân tạo trở thành "bác sĩ thầm lặng'"
Có thể bạn quan tâm

Nguyên nhân tàu metro Cát Linh - Hà Đông bị 'dột', khách che ô suốt hành trình
Tin nổi bật
10:28:28 20/05/2025
Vụ kẹo Kera: Thùy Tiên, Quang Linh Vlog, Hằng Du Mục nhận án phạt nặng, mất hết?
Pháp luật
10:23:02 20/05/2025
3 món đồ nội thất tưởng sang chảnh nhưng chủ nhà càng dùng càng hối hận
Sáng tạo
10:19:38 20/05/2025
Hai scandal lớn trong sự nghiệp của Hoa hậu Thùy Tiên
Sao việt
10:14:59 20/05/2025
Quán phao câu gà ế ẩm bỗng đắt khách nhờ buổi phát sóng kỳ lạ lúc nửa đêm
Netizen
10:12:28 20/05/2025
"Cha tôi, người ở lại" tập 41: Ông Bình bỏ đi khi Liên ngăn Nguyên hiến thận
Phim việt
10:10:49 20/05/2025
Tổng thống Trump, Putin công bố kết quả điện đàm
Thế giới
10:10:12 20/05/2025
Nhiều mẫu điện thoại được kết nối Internet vệ tinh Starlink miễn phí
Thế giới số
10:05:14 20/05/2025
Phương Mỹ Chi khoe nốt cao tại Trung Quốc trước dàn "quái thú" quốc tế, Quán quân Giọng Hát Việt lại bị chỉ trích
Nhạc việt
09:57:41 20/05/2025
"Nam thần tuổi thơ" hối hận vì dạy hư cả thế hệ trẻ
Sao châu á
09:53:03 20/05/2025
 Cô gái hôn mê 4 tháng tỉnh dậy nhờ nam y tá hát cho nghe mỗi ngày
Cô gái hôn mê 4 tháng tỉnh dậy nhờ nam y tá hát cho nghe mỗi ngày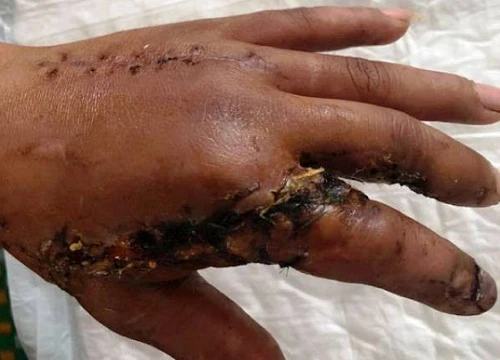 Bình Định: Nối thành công 2 ngón tay bị máy cưa cắt lìa cho bệnh nhân
Bình Định: Nối thành công 2 ngón tay bị máy cưa cắt lìa cho bệnh nhân
 Vợ gây chiến tranh lạnh vì chồng không trân trọng ái ân
Vợ gây chiến tranh lạnh vì chồng không trân trọng ái ân Điều chỉnh quy chế thi THPT quốc gia
Điều chỉnh quy chế thi THPT quốc gia Không lấy kết quả các kỳ thi để đánh giá xếp loại thi đua
Không lấy kết quả các kỳ thi để đánh giá xếp loại thi đua Khánh Hòa quyết liệt khắc phục bệnh thành tích trong giáo dục
Khánh Hòa quyết liệt khắc phục bệnh thành tích trong giáo dục Có thể lùi thời hạn bỏ cộng điểm nghề trong tuyển sinh vào lớp 10
Có thể lùi thời hạn bỏ cộng điểm nghề trong tuyển sinh vào lớp 10 Nâng cao chất lượng đào tạo tiến sĩ trong điều kiện tự chủ, hội nhập
Nâng cao chất lượng đào tạo tiến sĩ trong điều kiện tự chủ, hội nhập Luật Giáo dục đại học sửa đổi,bổ sung cần thống nhất với hệ thống luật khác
Luật Giáo dục đại học sửa đổi,bổ sung cần thống nhất với hệ thống luật khác Chồng cờ bạc rồi rượu chè, tôi có nên hàn gắn?
Chồng cờ bạc rồi rượu chè, tôi có nên hàn gắn? Bộ Tài nguyên và Môi trường muốn thay đổi gần 45% điều kiện kinh doanh
Bộ Tài nguyên và Môi trường muốn thay đổi gần 45% điều kiện kinh doanh Đay nghiến để chồng sửa đổi thì hôn nhân càng rơi vào bế tắc
Đay nghiến để chồng sửa đổi thì hôn nhân càng rơi vào bế tắc 5 điều cần tránh làm trong tình yêu nếu muốn hạnh phúc
5 điều cần tránh làm trong tình yêu nếu muốn hạnh phúc Bi kịch gia đình vì vợ vô lễ
Bi kịch gia đình vì vợ vô lễ Covid 19 đột biến chủng mới ở Thái Lan, TPHCM ghi nhận số ca nhiễm tăng nhanh
Covid 19 đột biến chủng mới ở Thái Lan, TPHCM ghi nhận số ca nhiễm tăng nhanh Thời điểm tốt nhất trong ngày để uống dầu cá
Thời điểm tốt nhất trong ngày để uống dầu cá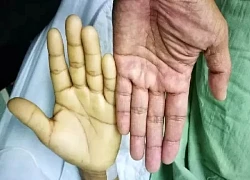 Hiểu lầm phổ biến về sữa của cha mẹ khiến bé 3 tuổi phải truyền máu
Hiểu lầm phổ biến về sữa của cha mẹ khiến bé 3 tuổi phải truyền máu Thận suy yếu âm thầm, hãy nhớ làm điều này để phòng xa
Thận suy yếu âm thầm, hãy nhớ làm điều này để phòng xa 4 không khi ăn sầu riêng
4 không khi ăn sầu riêng Covid-19 gia tăng tại một số nước, tình hình tại Việt Nam như thế nào?
Covid-19 gia tăng tại một số nước, tình hình tại Việt Nam như thế nào? 4 đồ uống nên tránh trước khi đi ngủ
4 đồ uống nên tránh trước khi đi ngủ Thói quen buổi sáng 'đầu độc' gan không kém bia rượu
Thói quen buổi sáng 'đầu độc' gan không kém bia rượu
 Thùy Tiên bị khởi tố: Vương miện Hoa hậu Hòa bình Quốc tế có bị tước?
Thùy Tiên bị khởi tố: Vương miện Hoa hậu Hòa bình Quốc tế có bị tước? Loạt ồn ào của Hoa hậu Nguyễn Thúc Thùy Tiên trước khi bị bắt
Loạt ồn ào của Hoa hậu Nguyễn Thúc Thùy Tiên trước khi bị bắt Số gỗ nghi là sưa đỏ đào dưới suối được xử lý như thế nào?
Số gỗ nghi là sưa đỏ đào dưới suối được xử lý như thế nào? Hoa hậu Thùy Tiên bị bắt, ekip phim Chốt Đơn lập tức có động thái gây hoang mang
Hoa hậu Thùy Tiên bị bắt, ekip phim Chốt Đơn lập tức có động thái gây hoang mang Sau hôm bị bắt nạt ở trường và được tôi "giải cứu", con riêng của chồng bỗng thay đổi 180 độ
Sau hôm bị bắt nạt ở trường và được tôi "giải cứu", con riêng của chồng bỗng thay đổi 180 độ Những động thái đáng chú ý của Hoa hậu Thùy Tiên trước khi bị khởi tố
Những động thái đáng chú ý của Hoa hậu Thùy Tiên trước khi bị khởi tố Thu nhập và khối tài sản của Hoa hậu Thùy Tiên trước khi bị khởi tố
Thu nhập và khối tài sản của Hoa hậu Thùy Tiên trước khi bị khởi tố Sốc: Phát hiện thi thể sao nam nổi tiếng trong rừng, 2 tay bị trói chặt
Sốc: Phát hiện thi thể sao nam nổi tiếng trong rừng, 2 tay bị trói chặt Vụ bố nhảy xuống giếng cứu con: Gần 2 giờ đấu tranh với "tử thần"
Vụ bố nhảy xuống giếng cứu con: Gần 2 giờ đấu tranh với "tử thần"


 Lời khai của Hoa hậu Thuỳ Tiên tại cơ quan điều tra
Lời khai của Hoa hậu Thuỳ Tiên tại cơ quan điều tra
 Cảnh sát công bố hình ảnh thực phẩm chức năng giả của vợ chồng dược sĩ Hà Nội
Cảnh sát công bố hình ảnh thực phẩm chức năng giả của vợ chồng dược sĩ Hà Nội Hoa hậu Nguyễn Thúc Thùy Tiên bị khởi tố
Hoa hậu Nguyễn Thúc Thùy Tiên bị khởi tố Hoa hậu Thùy Tiên "lách" trách nhiệm vụ kẹo Kera như thế nào?
Hoa hậu Thùy Tiên "lách" trách nhiệm vụ kẹo Kera như thế nào?