Indonesia sắp đưa vào sử dụng hai vaccine nội địa ngừa COVID-19
Ngày 26/8, người đứng đầu Cơ quan Giám sát Thực phẩm và Dược phẩm Indonesia (BPOM) – bà Penny Lukito cho biết nhiều khả năng 2 loại vaccine ngừa COVID-19 do nước này phát triển sẽ được cấp phép sử dụng khẩn cấp (EUA) trong tháng 9 tới.

Nhân viên tế tiêm vaccine ngừa COVID-19 cho người dân tại Tangerang, Indonesia. Ảnh: THX/TTXVN
Theo phóng viên TTXVN tại Jakarta, phát biểu tại Hội thảo phát triển thuốc nội địa, bà Lukito nêu rõ 2 loại vaccine trên đang được thử nghiệm lâm sàng giai đoạn cuối và đã được Tổng thống Joko Widodo đặt tên là “Indovac” và “Inavec”. Với nền tảng protein tái tổ hợp, Indovac do Viện sinh học phân tử Eijkman phối hợp với công ty dược phẩm quốc gia PT Bio Farma và Đại học Y Baylor (Mỹ) phát triển trong khuôn khổ chương trình của Bộ Doanh nghiệp Nhà nước (BUMN). Trong khi đó, Inavec dựa trên nền tảng virus bất hoạt và được Đại học Airlangga (Unair) phối hợp với công ty PT Biotis Pharmaceutical Indonesia phát triển.
Theo bà Lukito, cả 2 loại vaccine này đều đã vượt qua thử nghiệm lâm sàng giai đoạn 2 với kết quả tốt, có khả năng cải thiện hệ thống miễn dịch và kết quả không thua kém các loại vaccine cùng công nghệ đã được BPOM cấp EUA.
Bà Lukito cho biết BPOM đang tiến hành xem xét các báo cáo nghiên cứu về hàng nghìn đối tượng được tiêm mũi thứ 2 bằng các loại vaccine này, với kỳ vọng rằng các loại vaccine này sẽ được cấp EUA trong tháng tới và đáp ứng các tiêu chuẩn quốc tế. Cũng theo bà Lukito, ngoài cấp phép tiến hành thử nghiệm lâm sàng giai đoạn 3 đối với Indovac và Inavec, BPOM cũng đã phê duyệt kế hoạch thử nghiệm lâm sàng tiêm tăng cường 2 loại vaccine nội địa vào cuối năm nay.
Hàn Quốc cấp phép sử dụng vaccine ngừa COVID-19 nội địa đầu tiên
Ngày 29/6, Hàn Quốc đã cấp phép sử dụng vaccine SKYCovione, còn được gọi là GBP510, vaccine ngừa COVID-19 nội địa đầu tiên do công ty dược phẩm SK Bioscience phối hợp với Đại học Y khoa Washington (Mỹ) phát triển.
Đây là bước đi quan trọng hướng tới việc tự chủ về vaccine trong nỗ lực phòng chống đại dịch của Hàn Quốc.
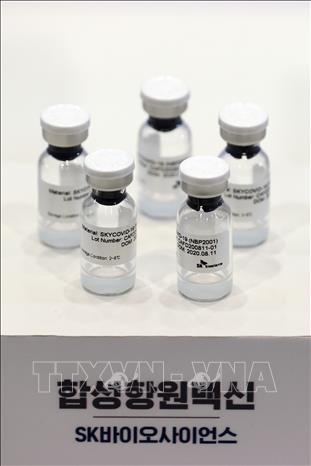
Vaccine ngừa COVID-19 do hãng dược phẩm SK Bioscience của Hàn Quốc phát triển. Ảnh tư liệu: Yonhap/TTXVN
Quyết định này được Bộ An toàn Thực phẩm và Dược phẩm Hàn Quốc (MFDS) đưa ra sau các cuộc tham vấn với Ủy ban Thanh tra cuối cùng thuộc bộ trên.
Trước đó, hôm 27/6, Ủy ban Đánh giá dược phẩm trung ương thuộc MFDS khuyến nghị cấp phép lưu hành loại vaccine này sau khi trải qua 3 giai đoạn thử nghiệm lâm sàng thành công. Không giống như các loại vaccine phòng COVID-19 được bào chế theo công nghệ mRNA, vector virus hoặc virus bất hoạt, GPB510 được phát triển từ các protein hình thành các hạt siêu nhỏ kèm các mảnh của virus SARS-CoV-2. Các hạt nano này được các nhà khoa học thuộc Đại học Y khoa Washington thiết kế và được SK Bioscience cùng GlaxoSmithKline đưa vào thử nghiệm lâm sàng.
Theo các chuyên gia, GPB510 là loại vaccine thế hệ thứ hai, an toàn và hiệu quả ở liều lượng thấp, dễ sản xuất trên quy mô lớn, dễ bảo quản mà không cần nhiệt độ lạnh sâu, tạo điều kiện thuận lợi để tiến hành tiêm chủng trên quy mô toàn cầu. Đây là loại vaccine gồm 2 liều và tiêm cách nhau 4 tuần. Hiện Chính phủ Hàn Quốc đã ký thỏa thuận mua 10 triệu liều vaccine này để sử dụng trong nước.
Nhật Bản có thể cấp phép lưu hành vaccine nội địa vào đầu năm sau  Theo phóng viên TTXVN tại Tokyo, công ty dược phẩm Shionogi có trụ sở tại tỉnh Osaka vừa thông báo về kế hoạch thử nghiệm lâm sàng quy mô lớn đối với vaccine ngừa COVID-19 nội địa đầu tiên của Nhật Bản do công ty này nghiên cứu, sản xuất, sau kết quả khả quan của giai đoạn thử nghiệm đầu tiên. Nhân...
Theo phóng viên TTXVN tại Tokyo, công ty dược phẩm Shionogi có trụ sở tại tỉnh Osaka vừa thông báo về kế hoạch thử nghiệm lâm sàng quy mô lớn đối với vaccine ngừa COVID-19 nội địa đầu tiên của Nhật Bản do công ty này nghiên cứu, sản xuất, sau kết quả khả quan của giai đoạn thử nghiệm đầu tiên. Nhân...
 Trung Quốc triển khai gần 60 máy bay sau phát ngôn của lãnh đạo Đài Loan?08:54
Trung Quốc triển khai gần 60 máy bay sau phát ngôn của lãnh đạo Đài Loan?08:54 Câu trả lời của Tổng thống Putin với đề xuất ngừng bắn ở Ukraine07:05
Câu trả lời của Tổng thống Putin với đề xuất ngừng bắn ở Ukraine07:05 Rộ tin Mỹ lên kịch bản rời khỏi ghế chỉ huy NATO06:44
Rộ tin Mỹ lên kịch bản rời khỏi ghế chỉ huy NATO06:44 Hái rau muống ở ven sông, người phụ nữ bị cá sấu kéo xuống ăn thịt00:35
Hái rau muống ở ven sông, người phụ nữ bị cá sấu kéo xuống ăn thịt00:35 Ông Trump muốn đàm phán lại biên giới Mỹ - Canada07:42
Ông Trump muốn đàm phán lại biên giới Mỹ - Canada07:42 Trung Quốc gửi thông điệp cứng rắn đến Đài Loan08:38
Trung Quốc gửi thông điệp cứng rắn đến Đài Loan08:38 Tàu dầu va chạm tàu hàng cháy ngùn ngụt, hàng chục người bị thương01:48
Tàu dầu va chạm tàu hàng cháy ngùn ngụt, hàng chục người bị thương01:48 Ukraine tấn công quy mô lớn vào Nga08:40
Ukraine tấn công quy mô lớn vào Nga08:40 Hơn 30 nước đồng minh NATO họp kín về Ukraine, Mỹ không được mời?09:41
Hơn 30 nước đồng minh NATO họp kín về Ukraine, Mỹ không được mời?09:41 Chiến đấu cơ Trung Quốc rơi trên đảo Hải Nam03:13
Chiến đấu cơ Trung Quốc rơi trên đảo Hải Nam03:13 Nga tuyên bố giành lại hầu hết vùng Kursk09:59
Nga tuyên bố giành lại hầu hết vùng Kursk09:59Tiêu điểm
Tin đang nóng
Tin mới nhất

Thủ tướng Lý Cường: Quan hệ Trung - Mỹ tiến tới bước ngoặt quan trọng

Giáo hoàng Francis phải tập nói

Cựu Tổng thống Biden lên kế hoạch trở lại chính trường

Ngoại trưởng Nhật - Trung - Hàn gặp nhau trước 'bước ngoặt lịch sử'

Tướng Mỹ: Trung Quốc sở hữu 'mạng lưới tiêu diệt' trên quỹ đạo

Thiếu trứng gà trầm trọng, Mỹ cần nhập 'hàng trăm triệu quả'

NATO trước viễn cảnh 'tan đàn xẻ nghé'

Israel căng thẳng cả trong lẫn ngoài

Rơi trực thăng ở miền Trung Nhật Bản

Mỹ đánh giá tích cực nỗ lực hạ nhiệt xung đột tại Ukraine

Israel tiếp tục tấn công các mục tiêu của Hezbollah

Khám phá bề dày văn hóa của thành phố Parma ở Italy
Có thể bạn quan tâm

Phim Hàn mới chiếu 1 ngày đã chiếm top 1 Việt Nam, nam chính bị ghét nhất showbiz nhưng diễn hay xuất thần
Phim châu á
23:45:02 23/03/2025
IU tham gia "Khi cuộc đời cho bạn quả quýt" vì Park Bo Gum
Hậu trường phim
23:42:02 23/03/2025
'Chàng quýt' Park Bo Gum: 15 tuổi gánh nợ thay bố, bị đồn hẹn hò Song Hye Kyo
Sao châu á
23:21:56 23/03/2025
MC Đại Nghĩa U50 vui đời độc thân, tậu nhà vườn tiền tỷ nghỉ dưỡng
Sao việt
23:19:09 23/03/2025
Từ ca hát đến diễn xuất đều thành công rực rỡ, đây là nữ nghệ sĩ khiến cả Kbiz phải thán phục
Nhạc quốc tế
22:26:47 23/03/2025
Không chỉ Sự Nghiệp Chướng, Pháo sẽ ra hẳn album về người yêu cũ?
Nhạc việt
22:16:29 23/03/2025
Kiều Oanh tiết lộ người 'se duyên', giúp cô từ cải lương sang đóng hài
Tv show
21:56:44 23/03/2025
Nợ công của Mỹ có thể vượt 200% GDP
Sức khỏe
21:42:12 23/03/2025
Tài xế lao ô tô vào hàng cây khiến 3 người bị thương có nồng độ cồn rất cao
Tin nổi bật
21:39:04 23/03/2025
Nửa đêm cậu bé nằng nặc đòi bố đưa đến trường để tìm bài tập, vừa dứt miệng mắng con phụ huynh liền khóc vì một thứ
Netizen
21:11:57 23/03/2025
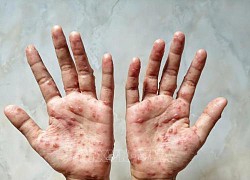 Mỹ: Giới chuyên gia nhận định dịch đậu mùa khỉ có thể đã đạt đỉnh
Mỹ: Giới chuyên gia nhận định dịch đậu mùa khỉ có thể đã đạt đỉnh Na Uy từ chối giảm giá khí đốt cho các nước châu Âu
Na Uy từ chối giảm giá khí đốt cho các nước châu Âu Tổng thống Indonesia thừa nhận khó đưa Nga và Ukraine đến bàn đàm phán hòa bình
Tổng thống Indonesia thừa nhận khó đưa Nga và Ukraine đến bàn đàm phán hòa bình Indonesia xem xét điều trị miễn phí cho bệnh nhân mắc đậu mùa khỉ
Indonesia xem xét điều trị miễn phí cho bệnh nhân mắc đậu mùa khỉ Nhật Bản nới lỏng khuyến cáo đi lại tới 55 quốc gia và khu vực
Nhật Bản nới lỏng khuyến cáo đi lại tới 55 quốc gia và khu vực Twitter đình chỉ tài khoản của 7 đại sứ quán Serbia
Twitter đình chỉ tài khoản của 7 đại sứ quán Serbia Indonesia đặt mục tiêu đón 7,4 triệu lượt du khách quốc tế vào năm 2023
Indonesia đặt mục tiêu đón 7,4 triệu lượt du khách quốc tế vào năm 2023 Giới chuyên gia bảo vệ quyết định tăng giá nhiên liệu trợ giá của Indonesia
Giới chuyên gia bảo vệ quyết định tăng giá nhiên liệu trợ giá của Indonesia Đặc phái viên Mỹ tiết lộ hành động bất ngờ của Tổng thống Nga Putin sau vụ ám sát hụt ông Trump
Đặc phái viên Mỹ tiết lộ hành động bất ngờ của Tổng thống Nga Putin sau vụ ám sát hụt ông Trump Toàn cảnh đàm phán tại Saudi Arabia về tiến trình kết thúc xung đột Nga - Ukraine
Toàn cảnh đàm phán tại Saudi Arabia về tiến trình kết thúc xung đột Nga - Ukraine Lý do các nước châu Âu cảnh báo công dân về du lịch Mỹ
Lý do các nước châu Âu cảnh báo công dân về du lịch Mỹ Một cố vấn Tổng thống Mỹ Donald Trump rút lui chỉ sau 2 tháng tại nhiệm
Một cố vấn Tổng thống Mỹ Donald Trump rút lui chỉ sau 2 tháng tại nhiệm Hàn Quốc: Ít nhất 4 người tử vong, 6 người bị thương do cháy rừng
Hàn Quốc: Ít nhất 4 người tử vong, 6 người bị thương do cháy rừng Mỹ không kích các mục tiêu của Houthi ngày thứ 7 liên tiếp
Mỹ không kích các mục tiêu của Houthi ngày thứ 7 liên tiếp Mỹ thu hồi tư cách pháp lý của trên 500.000 người nhập cư
Mỹ thu hồi tư cách pháp lý của trên 500.000 người nhập cư Tổng thống Trump nói lý do tỷ phú Musk sẽ không được thông báo về kế hoạch chiến tranh với Trung Quốc
Tổng thống Trump nói lý do tỷ phú Musk sẽ không được thông báo về kế hoạch chiến tranh với Trung Quốc Sốc: Nữ diễn viên Khi Cuộc Đời Cho Bạn Quả Quýt qua đời chỉ 1 tuần trước ngày phim lên sóng
Sốc: Nữ diễn viên Khi Cuộc Đời Cho Bạn Quả Quýt qua đời chỉ 1 tuần trước ngày phim lên sóng Quang Hải có chạnh lòng khi không thể "sang vì vợ"?
Quang Hải có chạnh lòng khi không thể "sang vì vợ"? Vụ cướp 2 triệu USD ở Tây Ninh: Con trai bị hại là chủ mưu
Vụ cướp 2 triệu USD ở Tây Ninh: Con trai bị hại là chủ mưu Pháo tụ tập Ngọc Kem, Emma Nhất Khanh giữa lúc ViruSs đang livestream giải thích
Pháo tụ tập Ngọc Kem, Emma Nhất Khanh giữa lúc ViruSs đang livestream giải thích
 Lời khai của người phụ nữ cưỡi vali giữa đường ở TPHCM
Lời khai của người phụ nữ cưỡi vali giữa đường ở TPHCM Tôn Lệ lộ tin nhắn cực chấn động: "Tôi tìm được chồng mới rồi!"
Tôn Lệ lộ tin nhắn cực chấn động: "Tôi tìm được chồng mới rồi!" Tìm thấy thi thể hai thiếu nữ buộc tay nhau dưới sông Dinh
Tìm thấy thi thể hai thiếu nữ buộc tay nhau dưới sông Dinh
 Bài rap diss viết trong 1 buổi sáng, chi phí dưới 2 triệu tiến thẳng Top 1 Trending, lật đổ Bắc Bling của Hòa Minzy
Bài rap diss viết trong 1 buổi sáng, chi phí dưới 2 triệu tiến thẳng Top 1 Trending, lật đổ Bắc Bling của Hòa Minzy Di chúc Huỳnh Hiểu Minh: Quý tử bị kiểm soát chặt, con gái út phải làm được 1 việc mới có thể lấy 17.500 tỷ?
Di chúc Huỳnh Hiểu Minh: Quý tử bị kiểm soát chặt, con gái út phải làm được 1 việc mới có thể lấy 17.500 tỷ? Soi camera thấy con gái nằm bất động trong khi các bạn đang học bài, mẹ bỉm tức tốc nhắn tin cho cô giáo
Soi camera thấy con gái nằm bất động trong khi các bạn đang học bài, mẹ bỉm tức tốc nhắn tin cho cô giáo Cặp đôi sắp cưới tiếp theo của Vbiz: Đàng trai đã có con riêng, nhà gái là mỹ nữ làng hài!
Cặp đôi sắp cưới tiếp theo của Vbiz: Đàng trai đã có con riêng, nhà gái là mỹ nữ làng hài!

 Thêm 1 sao nữ Vbiz vào cuộc sau bản "rap diss" của Pháo, trả lời rõ thái độ về bê bối tình ái hot nhất hiện nay
Thêm 1 sao nữ Vbiz vào cuộc sau bản "rap diss" của Pháo, trả lời rõ thái độ về bê bối tình ái hot nhất hiện nay Ca sĩ Sỹ Luân mất trí sau 2 lần mổ não
Ca sĩ Sỹ Luân mất trí sau 2 lần mổ não Vợ chồng Đà Nẵng chi 30 triệu 'biến xe tải thành nhà', đi đâu cũng bị hỏi 1 câu
Vợ chồng Đà Nẵng chi 30 triệu 'biến xe tải thành nhà', đi đâu cũng bị hỏi 1 câu