FDA Mỹ phê duyệt tiêm vaccine ACAM2000 ngừa đậu mùa khỉ cho người nguy cơ cao mắc bệnh
Ngày 29/8, công ty dược phẩm sinh học Emergent BioSolutions của Mỹ cho biết Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) nước này đã chấp thuận sử dụng rộng rãi vaccine ACAM2000 phòng bệnh đậu mùa khỉ (mpox) của hãng cho những người có nguy cơ mắc bệnh cao.
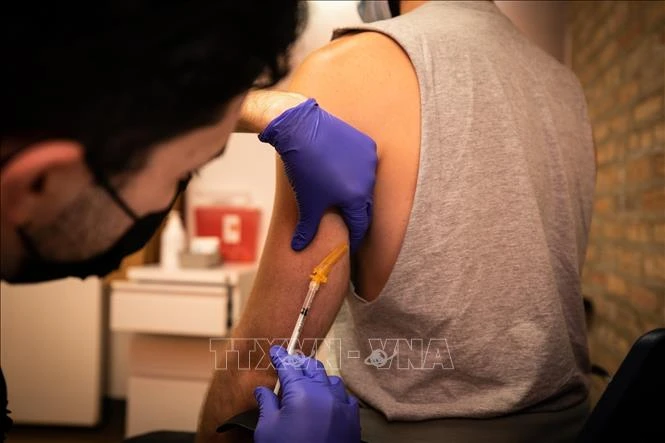
Nhân viên y tế tiêm vaccine phòng bệnh đậu mùa khỉ cho người dân tại Chicago, Mỹ. Ảnh: THX/TTXVN
Theo FDA, ACAM2000 là vaccine sống giảm độc lực, song có thể gây tác dụng phụ. Trung bình cứ 175 người tiêm vaccine ACAM2000 có 1 người gặp tình trạng viêm cơ tim hoặc viêm màng ngoài tim .
Quyết định mới nhất của FDA được đưa ra sau khi Emergent BioSolutions nộp đơn lên Tổ chức Y tế Thế giới (WHO) đăng ký đưa vaccine ACAM2000 vào danh mục khuyến cáo sử dụng khẩn cấp.
Vaccine sống như ACAM2000 là loại vaccine được sản xuất từ các tác nhân gây bệnh (virus hoặc vi khuẩn ) vẫn còn sống nhưng đã bị làm suy yếu. Các tác nhân đã giảm độc lực này khi được tiêm vào cơ thể sẽ vẫn hoạt động và tiếp tục nhân lên để tạo thành một quần thể đủ để kích thích hệ miễn dịch phát triển kháng thể, giúp cơ thể xây dựng miễn dịch. Khi gặp lại vi khuẩn hoặc virus trong tương lai, hệ miễn dịch đã được tiêm chủng sẽ có khả năng nhận biết và tiêu diệt tác nhân gây bệnh, giúp ngăn ngừa nhiễm bệnh hoặc nếu nhiễm bệnh sẽ không tiến triển nặng. Về cách thức tiêm phòng, thay vì một mũi như các loại vaccine thông thường, vaccine ACAM2000 được tiêm qua một loạt vết chích nhỏ trên da bằng kim tiêm có 2 mũi, tạo sẹo. Khoảng 2 đến 4 tuần sau tiêm, sẹo sẽ lành. Trong khoảng thời gian đó, virus sống đã được làm giảm độc lực có thể tỏa đi khắp các bộ phận của cơ thể, củng cố hệ miễn dịch. Tuy nhiên, FDA khuyến nghị không tiêm vaccine ACAM2000 cho những người có hệ miễn dịch suy yếu, chẳng hạn như người nhiễm virus HIV.
Video đang HOT
Đầu tháng 8 này, WHO đã ban bố tình trạng khẩn cấp về sức khỏe cộng đồng trên toàn cầu do bệnh đậu mùa khỉ bùng phát ở các nước châu Phi. Biến thể mới của virus là Clade 1b khiến dịch bệnh lây lan nhanh chóng tại đây.
Tuần trước, Emergent thông báo sẽ tặng 50.000 liều vaccine đậu mùa của công ty này cho CHDC Congo và các quốc gia bị ảnh hưởng khác gồm Burundi, Kenya, Rwanda và Uganda để ngăn chặn đợt bùng phát dịch bệnh đậu mùa khỉ hiện nay.
FDA Mỹ phê duyệt Vaccine Covid-19 bản cải tiến
Cục Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) vào thứ Năm (22/8) đã phê duyệt các loại vaccine COVID-19 cập nhật do Pfizer và Moderna sản xuất, nhằm phòng ngừa một biến thể mới của bệnh, kịp thời cho chiến dịch tiêm chủng mùa Thu và Đông sắp tới.
Hình ảnh tiêm vaccine tại bệnh viện Florida, Mỹ. Ảnh: Shannon Stapleton
Mẫu biến thể KP.2 đã được phát hiện vào đầu năm nay. Theo các công ty sản xuất dược phẩm, vaccine mới dự kiến sẽ có mặt trên khắp nước Mỹ trong những ngày tới.
Vào tháng 6, cơ quan quản lý y tế đã yêu cầu các nhà sản xuất vaccine có điều chỉnh đối phó với biến thể mới. Những loại vaccine mới nhất được nghiên cứu để nhắm chống lại các triệu chứng của các biến thể hiện đang lưu hành.
"Tiêm vaccin tiếp tục là nền tảng của việc phòng ngừa COVID-19," ông Peter Marks, Giám đốc Trung tâm Đánh giá và Nghiên cứu Sinh học của FDA, cho biết.
Biến thể KP.2 không còn phố biến, tuy nhiên vẫn có tính chất giống với các biến thể khác được ghi nhận tại Mỹ. Các nhà quản lý y tế hy vọng bảo vệ cộng đồng hiệu quả chống lại các biến thể lưu hành bằng cách điều chỉnh vaccine.
FDA đã cho phép sử dụng vaccine của Moderna, có thương hiệu là Spikevax, và Comirnaty, được phát triển chung bởi Pfizer và BioNTech, cho cả trẻ em từ sáu tháng tuổi trở lên và người lớn.
Các mũi tiêm cho trẻ em dưới 12 tuổi được phê duyệt cấp phép khẩn khấp.
Cơ quan quản lý chưa phê duyệt một mũi tiêm truyền thống dựa trên protein do Novavax sản xuất.
Novavax cho biết họ đang làm việc "hiệu quả" với FDA và hy vọng sẽ nhận được sự cho phép kịp thời cho mùa tiêm chủng cao điểm.
Công ty nói với truyền thông rằng họ đã sản xuất các mũi tiêm cập nhật trong suốt nhiều tháng để chờ phê duyệt. Vaccine của Novavax được phát triển trong tế bào côn trùng và mất nhiều tháng để sản xuất. Ví dụ, vào năm 2023, công ty cho biết họ cần sáu tháng để cung cấp đủ lượng vaccine ra thị trường.
Hiện tại số ca nhập viện và tử vong liên quan đến COVID-19 đã tăng trong ba tháng qua tại Mỹ. Tuy nhiên, nhu cầu tiêm vaccine đã giảm mạnh kể từ đỉnh điểm của đại dịch.
EC phê duyệt sử dụng vaccine ngừa RSV của Moderna cho người trên 60 tuổi  Theo phóng viên TTXVN tại Brussels, trong một động thái quan trọng nhằm bảo vệ sức khỏe cộng đồng, Ủy ban châu Âu (EC) ngày 23/8 đã chính thức cấp phép sử dụng vaccine mResvia do Moderna bào chế để ngừa virus hợp bào hô hấp (RSV) ở người trên 60 tuổi. Đây là lần đầu tiên EC cho phép tiêm vaccine mRNA...
Theo phóng viên TTXVN tại Brussels, trong một động thái quan trọng nhằm bảo vệ sức khỏe cộng đồng, Ủy ban châu Âu (EC) ngày 23/8 đã chính thức cấp phép sử dụng vaccine mResvia do Moderna bào chế để ngừa virus hợp bào hô hấp (RSV) ở người trên 60 tuổi. Đây là lần đầu tiên EC cho phép tiêm vaccine mRNA...
 Tàu chiến Mỹ và Venezuela 'dàn trận' ở Caribbean08:54
Tàu chiến Mỹ và Venezuela 'dàn trận' ở Caribbean08:54 Israel tuyên bố thành phố Gaza thành 'vùng chiến sự', phát hiện thi thể con tin07:08
Israel tuyên bố thành phố Gaza thành 'vùng chiến sự', phát hiện thi thể con tin07:08 Ấn Độ thử lửa mạng lưới "Vòm sắt": Đòn đánh hạ gục tên lửa, UAV03:03
Ấn Độ thử lửa mạng lưới "Vòm sắt": Đòn đánh hạ gục tên lửa, UAV03:03 'Lá bài' của Nhà Trắng với Trung Quốc08:33
'Lá bài' của Nhà Trắng với Trung Quốc08:33 Mỹ dọa trừng phạt cả Nga lẫn Ukraine08:03
Mỹ dọa trừng phạt cả Nga lẫn Ukraine08:03 Giám đốc CDC Mỹ bị sa thải sau chưa đầy một tháng?09:12
Giám đốc CDC Mỹ bị sa thải sau chưa đầy một tháng?09:12 Nga bác tin thả UAV sang Đức theo dõi tuyến vận chuyển vũ khí Mỹ08:21
Nga bác tin thả UAV sang Đức theo dõi tuyến vận chuyển vũ khí Mỹ08:21 Mỹ điều thêm tàu chiến, Tổng thống Venezuela tuyên bố cứng rắn08:45
Mỹ điều thêm tàu chiến, Tổng thống Venezuela tuyên bố cứng rắn08:45 Tàu chiến Mỹ 'dàn trận' ra sao ở cửa ngõ Venezuela?17:30
Tàu chiến Mỹ 'dàn trận' ra sao ở cửa ngõ Venezuela?17:30 Tổng thống Ukraine lên tiếng vụ cựu Chủ tịch Quốc hội bị bắn chết trên phố01:31
Tổng thống Ukraine lên tiếng vụ cựu Chủ tịch Quốc hội bị bắn chết trên phố01:31 Israel quyết dùng biện pháp mạnh tại Gaza08:30
Israel quyết dùng biện pháp mạnh tại Gaza08:30Tiêu điểm
Tin đang nóng
Tin mới nhất

Tổ chức Hợp tác Thượng Hải: Lực đẩy mới thách thức trật tự phương Tây

Nhiều nước châu Âu từ chối gửi quân tới Ukraine, chọn hướng hành động khác

Lý do Ấn Độ tăng cường bổ sung hệ thống S-400 của Nga, bất chấp áp lực từ Mỹ

Nga đảm bảo an toàn tuyệt đối cho Tổng thống Ukraine nếu đàm phán ở Moscow

Hàn Quốc lần đầu đăng ảnh thử vũ khí siêu vượt âm, đạt tốc độ Mach 6

Chân dung tân Thủ tướng Thái Lan Anutin Charnvirakul

"Phù thuỷ" Jack Ma chính thức nhập cuộc tiền số, cuộc chơi sắp đổi chiều?

Nga sắp có thỏa thuận bước ngoặt với Ấn Độ về "bóng ma bầu trời" Su-57?

'Không còn nơi nào an toàn ở Dải Gaza'

Ấn Độ bắt giữ nghi phạm đe dọa đánh bom Mumbai

Nghệ thuật 'xoay trục' của Tổng thống Trump về Ukraine

Điện Kremlin lên tiếng về việc giải quyết xung đột Nga-Ukraine
Có thể bạn quan tâm

Sang nhà dì chơi, tôi phải lòng em hàng xóm và cái kết hết sức bất ngờ
Góc tâm tình
22:27:00 06/09/2025
Đàn em ở Mỹ kể lại quá khứ với NSƯT Ngọc Trinh vừa qua đời
Sao việt
22:04:26 06/09/2025
Nhìn mỹ nhân này cứ tưởng công chúa Elsa bước ra đời thực: Giống đến từng chân tơ kẽ tóc, đẹp không thể tả nổi
Hậu trường phim
21:50:07 06/09/2025
2025 kiếm đâu ra phim Hàn nào cuốn hơn thế này: Nữ chính xuất quỷ nhập thần, rating dẫn đầu cả nước là đương nhiên
Phim châu á
21:45:21 06/09/2025
Chưa thấy ai càng ác càng đẹp gấp bội như mỹ nhân Việt này: Nhan sắc ma mị tràn màn hình, xứng đáng nhận 1000 like
Phim việt
21:39:12 06/09/2025
Cô gái cao 1m58 làm khuynh đảo làng bóng chuyền thế giới gây xôn xao
Sao thể thao
21:35:35 06/09/2025
Mỹ giảm viện trợ quân sự cho các nước châu Âu giáp biên giới với Nga

Xe sang Mercedes xả hàng tồn, giảm giá cả tỷ đồng tại Việt Nam
Ôtô
19:42:11 06/09/2025
Kim Jong Kook cưới gấp, chặn mọi hình ảnh vì cô dâu "chạy bầu"?
Sao châu á
19:39:11 06/09/2025
Hơn tuổi nhưng mặt non choẹt, chàng trai đi với người yêu toàn bị nhầm là mẹ con
Netizen
19:29:16 06/09/2025
 Động đất có độ lớn 5,9 tại bán đảo Kamchatka của Nga
Động đất có độ lớn 5,9 tại bán đảo Kamchatka của Nga Kinh tế Mỹ tăng trưởng mạnh hơn dự báo trong quý II
Kinh tế Mỹ tăng trưởng mạnh hơn dự báo trong quý II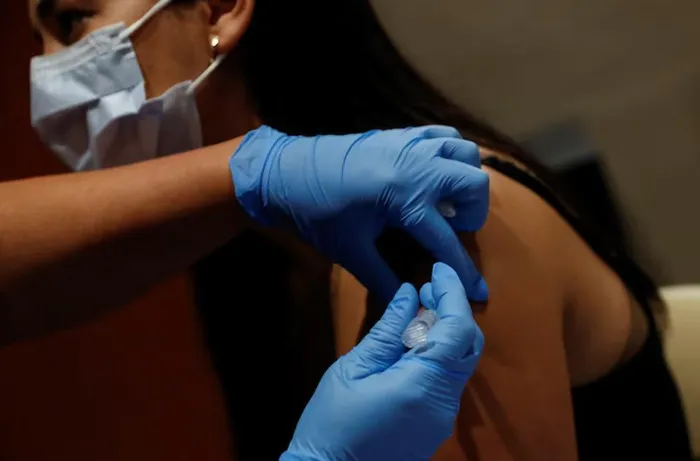
 Trung Quốc thử nghiệm lâm sàng vaccine điều trị ung thư công nghệ mRNA
Trung Quốc thử nghiệm lâm sàng vaccine điều trị ung thư công nghệ mRNA Thuốc tiểu đường của Cuba được cấp phép thử nghiệm lâm sàng ở Mỹ
Thuốc tiểu đường của Cuba được cấp phép thử nghiệm lâm sàng ở Mỹ Mỹ thu thập thông tin về sản phẩm gia vị của Ấn Độ nghi chứa chất gây ung thư
Mỹ thu thập thông tin về sản phẩm gia vị của Ấn Độ nghi chứa chất gây ung thư EU bác bỏ mối liên hệ giữa thuốc giảm cân và ý định tự tử
EU bác bỏ mối liên hệ giữa thuốc giảm cân và ý định tự tử Làn sóng tỷ lệ sinh thấp kỷ lục càn quét loạt nước phát triển châu Á
Làn sóng tỷ lệ sinh thấp kỷ lục càn quét loạt nước phát triển châu Á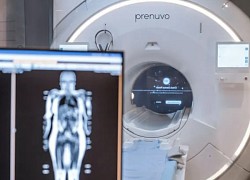 Người bệnh Mỹ xếp hàng chờ chụp cộng hưởng từ phát hiện sớm ung thư
Người bệnh Mỹ xếp hàng chờ chụp cộng hưởng từ phát hiện sớm ung thư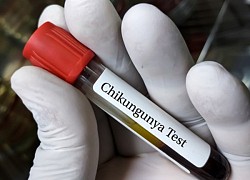 Mỹ phê duyệt vaccine đầu tiên trên thế giới ngừa virus Chikungunya
Mỹ phê duyệt vaccine đầu tiên trên thế giới ngừa virus Chikungunya Máy bay vận tải quân sự Nga hạ cánh khẩn cấp
Máy bay vận tải quân sự Nga hạ cánh khẩn cấp Biển số xe đặc biệt của Chủ tịch Triều Tiên Kim Jong-un khi thăm Trung Quốc
Biển số xe đặc biệt của Chủ tịch Triều Tiên Kim Jong-un khi thăm Trung Quốc Ukraine tập kích nhà máy lọc dầu lớn nhất của Nga
Ukraine tập kích nhà máy lọc dầu lớn nhất của Nga Nga lên tiếng khi châu Âu lên kế hoạch đưa quân đến Ukraine hậu chiến sự
Nga lên tiếng khi châu Âu lên kế hoạch đưa quân đến Ukraine hậu chiến sự Thái Lan: Ông Anutin Charnvirakul được bầu làm Thủ tướng
Thái Lan: Ông Anutin Charnvirakul được bầu làm Thủ tướng Tổng thống Nga mời Tổng thống Ukraine đến Moskva đàm phán
Tổng thống Nga mời Tổng thống Ukraine đến Moskva đàm phán Nga phản đối Anh sử dụng tài sản đóng băng để hỗ trợ Ukraine
Nga phản đối Anh sử dụng tài sản đóng băng để hỗ trợ Ukraine Ông Thaksin giải thích lý do ban đầu định sang Singapore cuối cùng đến Dubai
Ông Thaksin giải thích lý do ban đầu định sang Singapore cuối cùng đến Dubai Đang tổ chức đám cưới, chú rể suýt ngất xỉu khi thấy nhan sắc cô dâu
Đang tổ chức đám cưới, chú rể suýt ngất xỉu khi thấy nhan sắc cô dâu Rúng động showbiz: "Mỹ nhân phim giờ vàng" tố cáo bị con trai phó tổng giám đốc đài truyền hình chuốc thuốc, cưỡng bức
Rúng động showbiz: "Mỹ nhân phim giờ vàng" tố cáo bị con trai phó tổng giám đốc đài truyền hình chuốc thuốc, cưỡng bức Yêu thầm chị dâu cũ, tôi có sai quá không?
Yêu thầm chị dâu cũ, tôi có sai quá không? Vì sao Vu Chính yêu nhất Triệu Lệ Dĩnh, hận nhất Viên San San?
Vì sao Vu Chính yêu nhất Triệu Lệ Dĩnh, hận nhất Viên San San? Quang Huy - người đàn ông khiến Bảo Anh và Phạm Quỳnh Anh "căng thẳng" suốt 7 năm giờ ra sao?
Quang Huy - người đàn ông khiến Bảo Anh và Phạm Quỳnh Anh "căng thẳng" suốt 7 năm giờ ra sao? Tảng băng lớn nhất thế giới sắp biến mất
Tảng băng lớn nhất thế giới sắp biến mất Tóm dính 1 "thánh ế showbiz" hẹn hò mỹ nhân kém 18 tuổi đẹp như Hoa hậu!
Tóm dính 1 "thánh ế showbiz" hẹn hò mỹ nhân kém 18 tuổi đẹp như Hoa hậu! 10 mỹ nhân bạch y đẹp nhất Trung Quốc: Lưu Diệc Phi chỉ xếp thứ 2, hạng 1 đúng chuẩn phong hoa tuyệt đại
10 mỹ nhân bạch y đẹp nhất Trung Quốc: Lưu Diệc Phi chỉ xếp thứ 2, hạng 1 đúng chuẩn phong hoa tuyệt đại Vụ quạt cho tiểu tam ngoài đường: Thanh niên tái hôn với bạn học cấp 3, giờ lại ngoại tình với bạn học cấp 2
Vụ quạt cho tiểu tam ngoài đường: Thanh niên tái hôn với bạn học cấp 3, giờ lại ngoại tình với bạn học cấp 2 Nữ tỷ phú bị hoa hậu đẹp nhất lịch sử cướp chồng, màn trả thù khiến cả Hong Kong rung động
Nữ tỷ phú bị hoa hậu đẹp nhất lịch sử cướp chồng, màn trả thù khiến cả Hong Kong rung động Hoá ra đây là nhân vật khiến Phạm Quỳnh Anh tức giận, im lặng với Bảo Anh suốt 7 năm!
Hoá ra đây là nhân vật khiến Phạm Quỳnh Anh tức giận, im lặng với Bảo Anh suốt 7 năm! 3 cuộc hôn nhân bí ẩn nhất Vbiz: "Nam thần màn ảnh" cưới vợ hào môn không ai hay, sốc nhất đôi tan vỡ vẫn chưa lộ mặt
3 cuộc hôn nhân bí ẩn nhất Vbiz: "Nam thần màn ảnh" cưới vợ hào môn không ai hay, sốc nhất đôi tan vỡ vẫn chưa lộ mặt 7 ngôi sao diễn hay nhất Việt Nam: Trấn Thành xếp sau Tuấn Trần, hạng 1 đẳng cấp hàng đầu không ai dám ý kiến
7 ngôi sao diễn hay nhất Việt Nam: Trấn Thành xếp sau Tuấn Trần, hạng 1 đẳng cấp hàng đầu không ai dám ý kiến Lê Ngọc Trinh đính chính thông tin đã qua đời
Lê Ngọc Trinh đính chính thông tin đã qua đời Vụ án sản xuất kẹo Kera - khách hàng đã bị lừa dối như thế nào?
Vụ án sản xuất kẹo Kera - khách hàng đã bị lừa dối như thế nào? Hoàng Dung đẹp nhất màn ảnh tự vẫn vì tình, phải 40 năm sau sự thật mới được hé lộ
Hoàng Dung đẹp nhất màn ảnh tự vẫn vì tình, phải 40 năm sau sự thật mới được hé lộ Cuộc sống chật vật của con gái tỷ phú giàu có hàng đầu thế giới
Cuộc sống chật vật của con gái tỷ phú giàu có hàng đầu thế giới Phạm Quỳnh Anh tung full đoạn chat đáp trả Bảo Anh, giải thích lý do im lặng nhưng netizen vẫn "ném đá" không ngừng vì 1 chi tiết
Phạm Quỳnh Anh tung full đoạn chat đáp trả Bảo Anh, giải thích lý do im lặng nhưng netizen vẫn "ném đá" không ngừng vì 1 chi tiết