Bộ Y tế phê duyệt vaccine COVID-19 của Pfizer
Ngày 12/6, Bộ Y tế có quyết định phê duyệt có điều kiện cho nhu cầu cấp bách trong phòng chống dịch COVID-19 đối với vaccine Comirnaty của hãng Pfizer, Việt Nam.
Trong quyết định, Bộ Y tế nêu rõ các điều kiện đi kèm việc phê duyệt vaccine Comirnaty cho nhu cầu cấp bách trong giai đoạn phòng, chống dịch bệnh COVID-19 (vaccine Comirnaty được phê duyệt dựa trên dữ liệu an toàn, chất lượng và hiệu quả do Công ty TNHH Pfizer (Việt Nam) cung cấp cho Bộ Y tế tính đến ngày 28/5/2021.
Công ty TNHH Pfizer phải chịu trách nhiệm về việc các tài liệu đã cung cấp cho Bộ Y tế Việt Nam.
Video đang HOT
Vaccine COVID-19 của Pfizer. (Ảnh: Economic Times)
Pfizer cũng có trách nhiệm phản hồi kịp thời các yêu cầu từ Bộ Y tế để bổ sung thêm dữ liệu hoặc các yêu cầu khác có liên quan đến vaccine Comirnaty và chủ động cung cấp, cập nhật các thông tin mới có liên quan đến vaccine này cho Bộ Y tế trong suốt quá trình phát triển sản phẩm.
Phối hợp với cơ sở sản xuất vaccine đảm bảo điều kiện sản xuất tại cơ sở sản xuất vaccine Comirnaty nhập khẩu vào Việt Nam và đảm bảo an toàn, hiệu quả và chất lượng của lô vaccine Comirnaty nhập khẩu vào Việt Nam.
Phối hợp với đơn vị phân phối, sử dụng vaccine Comirnaty triển khai hệ thống cảnh giác dược toàn diện đối với vaccine này tại Việt Nam theo quy định của pháp luật.
Cùng với đó, Pfizer cũng phải phối hợp với Cục Khoa học công nghệ và Đào tạo (Bộ Y tế) và đơn vị có đủ điều kiện tổ chức việc đánh giá tính an toàn, hiệu quả của vaccine Comirnaty trên cơ sở ý kiến tư vấn của Hội đồng tư vấn sử dụng vaccine , sinh phẩm y tế (Bộ Y tế) trong quá trình sử dụng.
Công ty này với Viện Kiểm định Quốc gia vaccine và sinh phẩm y tế phải phối hợp trong việc kiểm định các lô vaccine Comirnaty trước khi đưa ra sử dụng; phối hợp với Cục Y tế dự phòng hướng dẫn việc bảo quản, phân phối và sử dụng vaccine Comirnaty cho các cơ sơ tiêm chủng.
Pfizer cũng cần Bộ Y tế Việt Nam triển khai quản trị rủi ro đối với vaccine Comirnaty trong suốt quá trình lưu hành tại Việt Nam. Ngoài ra, việc sử dụng vaccine Comirnaty phải theo hướng dẫn của Bộ Y tế.
Đề nghị Bộ Y tế phê duyệt khẩn cấp vắc xin của Pfizer
Thông tin từ Bộ Y tế cho hay Hội đồng tư vấn cấp phép lưu hành thuốc, vắc xin và sinh phẩm y tế của bộ này đã nhóm họp từ hôm qua 7-6, đến nay đã thống nhất đề nghị bộ trưởng Bộ Y tế phê duyệt nhập khẩu khẩn cấp vắc xin này.
Theo nguồn tin trên, khi bộ trưởng Bộ Y tế phê duyệt, đây là vắc xin ngừa COVID-19 thứ 4 được nhập khẩu vào Việt Nam, sau vắc xin AstraZeneca của Anh, vắc xin Sputnik V của Nga và vắc xin của Công ty Sinopharm (Trung Quốc).
Trước đó, từ ngày 7-6, Hội đồng tư vấn của Bộ Y tế với sự tham gia của các chuyên gia về thuốc, vắc xin, sinh phẩm y tế đã nhóm họp. Đến thời điểm này, hội đồng đã thống nhất đệ trình bộ trưởng Bộ Y tế phê duyệt nhập khẩu.
Vắc xin Pfizer là một trong số các vắc xin ngừa COVID-19 được quan tâm nhiều nhất hiện nay và được sử dụng nhiều tại Mỹ và châu Âu. Được phát triển từ đầu năm 2020, vắc xin này cũng đã được Tổ chức Y tế thế giới (WHO) phê duyệt, dựa trên các hồ sơ về tính an toàn và sinh miễn dịch của vắc xin.
Tại Việt Nam, Bộ Y tế cho biết đã đàm phán mua 31 triệu liều Pfizer và lô vắc xin đầu tiên có thể về Việt Nam trong thời gian từ nay đến tháng 7-2021.
Cấp phép nhập khẩu vaccine Covid-19 trong 5-10 ngày  Các địa phương, doanh nghiệp muốn nhập khẩu vaccine Covid-19, có thể được Bộ Y tế phê duyệt cấp phép khẩn cấp trong vòng 5-10 ngày làm việc nếu đủ hồ sơ hợp lệ. Ông Vũ Tuấn Cường, Cục trưởng Quản lý Dược, Bộ Y tế, ngày 8/6 cho biết như trên. "Nếu các địa phương, doanh nghiệp, tập đoàn tiếp cận được...
Các địa phương, doanh nghiệp muốn nhập khẩu vaccine Covid-19, có thể được Bộ Y tế phê duyệt cấp phép khẩn cấp trong vòng 5-10 ngày làm việc nếu đủ hồ sơ hợp lệ. Ông Vũ Tuấn Cường, Cục trưởng Quản lý Dược, Bộ Y tế, ngày 8/6 cho biết như trên. "Nếu các địa phương, doanh nghiệp, tập đoàn tiếp cận được...
 Vụ ô tô Mercedes lao xuống biển Nha Trang, xác định danh tính 4 cô gái đi cùng13:53
Vụ ô tô Mercedes lao xuống biển Nha Trang, xác định danh tính 4 cô gái đi cùng13:53 Người lạ vào tận trường mầm non nghi bắt cóc bé gái 4 tuổi10:53
Người lạ vào tận trường mầm non nghi bắt cóc bé gái 4 tuổi10:53 Khách Tây sốc khi lần đầu "đi bão" mừng đội tuyển Việt Nam vô địch AFF Cup01:33
Khách Tây sốc khi lần đầu "đi bão" mừng đội tuyển Việt Nam vô địch AFF Cup01:33 Người đàn ông trùm kín mít, bấm đèn đỏ khiến xe dừng không kịp ở TPHCM00:54
Người đàn ông trùm kín mít, bấm đèn đỏ khiến xe dừng không kịp ở TPHCM00:54 Người dân sợ bị phạt khi leo lề, rẽ phải nhường đường xe cấp cứu lúc bị kẹt xe09:12
Người dân sợ bị phạt khi leo lề, rẽ phải nhường đường xe cấp cứu lúc bị kẹt xe09:12 Hơn 130 giao lộ ở TP.HCM cho xe máy rẽ phải khi đèn đỏ08:48
Hơn 130 giao lộ ở TP.HCM cho xe máy rẽ phải khi đèn đỏ08:48 Xác minh người mặc đồ GrabBike chỉnh tín hiệu đèn giao thông ở TPHCM12:11
Xác minh người mặc đồ GrabBike chỉnh tín hiệu đèn giao thông ở TPHCM12:11 Rùng mình hiện trường Jeju Air: Vật thể lạ xuất hiện, nỗ lực cuối của phi công?02:43
Rùng mình hiện trường Jeju Air: Vật thể lạ xuất hiện, nỗ lực cuối của phi công?02:43 TP.HCM "thất thủ": Phạt "kịch khung" vẫn không ngăn được "quái xế" lộng hành?03:09
TP.HCM "thất thủ": Phạt "kịch khung" vẫn không ngăn được "quái xế" lộng hành?03:09 Vợ Xuân Son 'tức tốc' vào viện, nhận thông báo từ bác sĩ, làm 1 việc chạnh lòng?03:18
Vợ Xuân Son 'tức tốc' vào viện, nhận thông báo từ bác sĩ, làm 1 việc chạnh lòng?03:18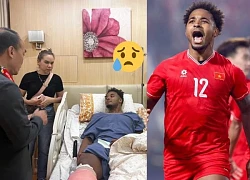 Vụ tin giả về Xuân Son: Việt Nam vô địch không cần anh, VFF 'dẹp' loạn MXH?03:02
Vụ tin giả về Xuân Son: Việt Nam vô địch không cần anh, VFF 'dẹp' loạn MXH?03:02Tiêu điểm
Tin đang nóng
Tin mới nhất

Vụ 4 người chết ở Hà Nội: 3 thi thể được tìm thấy dưới gầm giường

Lý do tàu metro số 1 Bến Thành - Suối Tiên phải dừng khẩn cấp

Sắt từ xe đầu kéo đổ xuống đường ở TPHCM, một người bị thương

Ngã ra đường khi vượt xe tải, ông lão bị xe cán tử vong tại chỗ

Một người dân ở Thanh Hóa tử vong khi đang dựng cây nêu chơi Tết

Chán cảnh kẹt xe, nam nhân viên văn phòng ở TPHCM đi bộ 6km về nhà

Khu tái định cư hàng chục tỷ đồng, chỉ 2 hộ dân đến làm nhà rồi rời đi

Khoảnh khắc xe Mercedes chở 5 người lao xuống biển Nha Trang

Cho thôi nhiệm vụ đại biểu Quốc hội với ông Dương Văn An

Hà Nội: Bốn ô tô đâm liên hoàn trên cầu vượt ngã tư Vọng

Cô gái trình báo bị lừa hơn 200 triệu đồng rồi tử vong dưới sông Đồng Nai

Lộ diện linh vật rắn khổng lồ, robot biết nói ở đường hoa Nguyễn Huệ 2025
Có thể bạn quan tâm

Bạn trai tin đồn của Diệp Lâm Anh: Kém 11 tuổi, quán quân cuộc thi người mẫu
Sao việt
08:00:33 18/01/2025
Lương Thùy Linh - ngôi sao mặc đẹp đang lên
Phong cách sao
07:28:01 18/01/2025
Phe ông Yoon cáo buộc lãnh đạo cơ quan điều tra 'vi phạm bí mật quân sự'
Thế giới
07:21:04 18/01/2025
Đi về miền có nắng - Tập 10: Cho tiểu thư leo cây, thiếu gia ở bên mẹ đơn thân
Phim việt
07:05:59 18/01/2025
Người đáng thương nhất giữa lục đục nội bộ của BIGBANG
Nhạc quốc tế
06:54:35 18/01/2025
Cực phẩm nhạc lụy mới của Vpop: Cắt đoạn nào viral đoạn đó, câu từ "suy đét" khiến netizen thấm vô cùng
Nhạc việt
06:49:59 18/01/2025
Lật mở hồ sơ tội ác lừa đảo, tra tấn man rợ, buôn người xuyên biên giới của em chồng Triệu Vy
Sao châu á
06:34:58 18/01/2025
3 loại hạt tốt cho tim mạch lại không lo tích mỡ bụng
Sức khỏe
06:28:12 18/01/2025
Trời lạnh và khô, chị em nên mua thêm loại nguyên liệu này về nấu 3 món ngon vừa giàu collagen giúp da mịn đẹp mà giá rất rẻ
Ẩm thực
06:16:16 18/01/2025
Màn ảnh Hàn lại có siêu phẩm lãng mạn: Nữ thần công sở đẹp mê đắm, đỉnh cao nhan sắc chính là đây!
Phim châu á
06:03:06 18/01/2025
 Tiền Giang: Người bán thịt lợn nghi mắc COVID-19, cả chợ bị phong tỏa
Tiền Giang: Người bán thịt lợn nghi mắc COVID-19, cả chợ bị phong tỏa Tìm người đến 2 địa điểm ở quận 12 liên quan ca dương tính nCoV
Tìm người đến 2 địa điểm ở quận 12 liên quan ca dương tính nCoV

 10 ca mắc mới Covid-19 là cán bộ làm việc ở cao tốc Trung Lương - Mỹ Thuận
10 ca mắc mới Covid-19 là cán bộ làm việc ở cao tốc Trung Lương - Mỹ Thuận Việt Nam nghiên cứu sản xuất vaccine Covid-19 một liều tiêm
Việt Nam nghiên cứu sản xuất vaccine Covid-19 một liều tiêm Bình Dương: Lên phương án tiêm vắc-xin Covid-19 cho công nhân
Bình Dương: Lên phương án tiêm vắc-xin Covid-19 cho công nhân TPHCM: 5 người trong gia đình nhiễm SARS-CoV-2 từ xưởng cơ khí
TPHCM: 5 người trong gia đình nhiễm SARS-CoV-2 từ xưởng cơ khí Trưa 12/6, thêm 89 ca Covid-19 tại 5 tỉnh thành
Trưa 12/6, thêm 89 ca Covid-19 tại 5 tỉnh thành 4 ca Covid-19 chưa rõ nguồn lây tại TP.HCM cư trú ở đâu?
4 ca Covid-19 chưa rõ nguồn lây tại TP.HCM cư trú ở đâu? Vụ gần 1.600 con lợn bị thiêu sống: "Tôi mất bình tĩnh quên cúp điện"
Vụ gần 1.600 con lợn bị thiêu sống: "Tôi mất bình tĩnh quên cúp điện" Công an TPHCM: Phạt người vượt đèn nhường đường xe cứu thương là sai
Công an TPHCM: Phạt người vượt đèn nhường đường xe cứu thương là sai Jason Quang Vinh Pendant báo tin vui đến HLV Kim Sang Sik
Jason Quang Vinh Pendant báo tin vui đến HLV Kim Sang Sik Dựng cây nêu trước nhà, 2 anh em họ bị điện giật thương vong
Dựng cây nêu trước nhà, 2 anh em họ bị điện giật thương vong Một người đi bộ trên đường ray bị tàu hỏa tông tử vong
Một người đi bộ trên đường ray bị tàu hỏa tông tử vong Dập tắt vụ cháy nhà dân tại xã Sông Trầu, không có thiệt hại về người
Dập tắt vụ cháy nhà dân tại xã Sông Trầu, không có thiệt hại về người Đắk Lắk: va chạm với xe tải, một người đàn ông tử vong
Đắk Lắk: va chạm với xe tải, một người đàn ông tử vong
 Nóng: Sao nam 10X bị lừa bán sang biên giới Thái Lan được giải cứu thành công, nhìn ngón tay cái ai cũng thấy khiếp sợ
Nóng: Sao nam 10X bị lừa bán sang biên giới Thái Lan được giải cứu thành công, nhìn ngón tay cái ai cũng thấy khiếp sợ Vụ gần 47 tỷ đồng gửi Sacombank "bốc hơi": Tạm dừng phiên tòa
Vụ gần 47 tỷ đồng gửi Sacombank "bốc hơi": Tạm dừng phiên tòa Tài sản lớn nhất của 'trùm phản diện' Hoàng Phúc tuổi U.60
Tài sản lớn nhất của 'trùm phản diện' Hoàng Phúc tuổi U.60 Tiếp viên hàng không xinh đẹp bỏ việc về quê nuôi lợn nhận cái kết bất ngờ
Tiếp viên hàng không xinh đẹp bỏ việc về quê nuôi lợn nhận cái kết bất ngờ Bức ảnh xấu hổ nhất cuộc đời Song Hye Kyo
Bức ảnh xấu hổ nhất cuộc đời Song Hye Kyo Dọn nhà, cặp đôi vứt nhầm gần 800 triệu đồng tiền mặt vào thùng rác
Dọn nhà, cặp đôi vứt nhầm gần 800 triệu đồng tiền mặt vào thùng rác "Tiểu tam" bị ghét nhất showbiz lộ chuyện mang thai con đầu lòng với người tình U70, "chính thất" liền có phản ứng này
"Tiểu tam" bị ghét nhất showbiz lộ chuyện mang thai con đầu lòng với người tình U70, "chính thất" liền có phản ứng này Sốc: Triệu Vy là chủ mưu đứng sau đường dây buôn người sang Thái Lan - Myanmar?
Sốc: Triệu Vy là chủ mưu đứng sau đường dây buôn người sang Thái Lan - Myanmar? Con gái riêng chồng cũ Vũ Thu Phương nói về việc bị bạo hành: "Không lý do gì tôi phải dựng chuyện hạ bệ ai"
Con gái riêng chồng cũ Vũ Thu Phương nói về việc bị bạo hành: "Không lý do gì tôi phải dựng chuyện hạ bệ ai" Hé lộ phần quà cô dâu hào môn Phương Nhi tặng khách mời trong lễ ăn hỏi
Hé lộ phần quà cô dâu hào môn Phương Nhi tặng khách mời trong lễ ăn hỏi
 Người đàn ông chém gục vợ cũ giữa đường rồi tự sát ở Cà Mau
Người đàn ông chém gục vợ cũ giữa đường rồi tự sát ở Cà Mau Á hậu Phương Nhi phản ứng thế nào sau 1 ngày tổ chức đám hỏi với thiếu gia Vingroup?
Á hậu Phương Nhi phản ứng thế nào sau 1 ngày tổ chức đám hỏi với thiếu gia Vingroup? Sự thật về việc Á hậu Phương Nhi âm thầm xây dựng biệt thự khủng như lâu đài
Sự thật về việc Á hậu Phương Nhi âm thầm xây dựng biệt thự khủng như lâu đài Sự trùng hợp khó tin: 4 Á hậu thi Hoa hậu Quốc tế xong đều lấy chồng, đàng trai toàn gia thế cực "khủng"
Sự trùng hợp khó tin: 4 Á hậu thi Hoa hậu Quốc tế xong đều lấy chồng, đàng trai toàn gia thế cực "khủng" Vợ Duy Mạnh cổ vũ ĐT Việt Nam "bằng cả tính mạng" đến nỗi ngất trên khán đài nhưng bị chồng dỗi vì 1 điều
Vợ Duy Mạnh cổ vũ ĐT Việt Nam "bằng cả tính mạng" đến nỗi ngất trên khán đài nhưng bị chồng dỗi vì 1 điều Dispatch mở bát 2025: Tiểu tam trơ trẽn nhất showbiz mang thai con ngoài giá thú với đạo diễn U70 sau 10 năm ngoại tình
Dispatch mở bát 2025: Tiểu tam trơ trẽn nhất showbiz mang thai con ngoài giá thú với đạo diễn U70 sau 10 năm ngoại tình