Bộ Y tế có thể cho đăng ký lưu hành vắc xin COVID-19 nội khẩn cấp trong 20 ngày
Trong hướng dẫn vừa ban hành ngày 19-8, Bộ Y tế có rất nhiều sửa đổi về quy chế đăng ký vắc xin, mở ra cơ hội đăng ký lưu hành các vắc xin ngừa COVID-19 nội địa và chuyển giao công nghệ.
Tiêm Nano Covax cho người tình nguyện tham gia thử nghiệm lâm sàng giai đoạn 2 tại Long An – Ảnh: H.L.
Theo hướng dẫn này, vắc xin sản xuất trong nước đang thực hiện thử lâm sàng nhưng đã có kết quả đánh giá giữa kỳ giai đoạn 3 về tính an toàn, hiệu quả bảo vệ thì có thể xem xét cấp phép có điều kiện, trên cơ sở ý kiến của Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia.
Bên cạnh đó, Bộ Y tế cũng lấy ý kiến tư vấn của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc và tham khảo hướng dẫn của Tổ chức Y tế thế giới.
Vắc xin được cấp phép lưu hành có điều kiện được tiếp tục theo dõi về tính an toàn, hiệu quả, kiểm soát về số lượng, đối tượng, phạm vi sử dụng sau khi được cấp đăng ký lưu hành.
Trường hợp vắc xin đã được cấp phép lưu hành tại ít nhất một nước trên thế giới và có dữ liệu về tính an toàn, hiệu quả, vắc xin chuyển giao công nghệ tại Việt Nam và trước khi chuyển giao công nghệ có dữ liệu lâm sàng về tính an toàn, hiệu quả, được cấp phép tại ít nhất 1 nước trên thế giới có thể xem xét miễn 1 hoặc một số giai đoạn thử lâm sàng.
Video đang HOT
Nếu vắc xin đã được cấp phép nhưng cần đánh giá thêm về tính an toàn, hiệu quả thì phải thử nghiệm lâm sàng giai đoạn 4 tại Việt Nam.
Về thủ tục cấp giấy lưu hành vắc xin, Bộ Y tế hướng dẫn trong vòng 20 ngày làm việc kể từ khi nhận được đủ hồ sơ, Cục Quản lý dược sẽ cấp giấy phép đăng ký lưu hành vắc xin, trong trường hợp chưa cấp, cục sẽ phải thông báo rõ lý do.
Theo các quy định kể trên, hướng dẫn đăng ký lưu hành vắc xin khẩn cấp đã có nhiều điểm mới so với thông thường, trong đó thông thường vắc xin mới sẽ phải hoàn tất 3 giai đoạn thử nghiệm lâm sàng mới được xem xét cấp phép và phải chứng minh hiệu quả bảo vệ của vắc xin. Với hướng dẫn này, Bộ Y tế cho phép cấp phép sau khi có đánh giá giữa kỳ giai đoạn 3.
Về hiệu quả bảo vệ, cho phép dựa trên tính sinh miễn dịch của vắc xin để đáp ứng yêu cầu về thời gian trong tình hình chống dịch, do theo dõi hiệu quả bảo vệ của vắc xin cần có thời gian.
Tại Việt Nam hiện có 3 vắc xin đang thử nghiệm lâm sàng, gồm 2 vắc xin nội Nano Covax đã nộp báo cáo đánh giá giữa kỳ thử nghiệm lâm sàng giai đoạn 3 lên Bộ Y tế hôm nay 20-8; Covivac vừa bước vào thử nghiệm lâm sàng giai đoạn 2 và Arct-154 (vắc xin chuyển giao công nghệ) vừa bước vào thử nghiệm lâm sàng giai đoạn 1.
Trong trường hợp ứng viên vắc xin đạt yêu cầu về tính an toàn và tính sinh miễn dịch (qua đó đánh giá hiệu quả bảo vệ), Bộ Y tế có thể xem xét cấp phép trong điều kiện khẩn cấp.
Với Nano Covax, sau khi nhận báo cáo đánh giá giữa kỳ thử nghiệm lâm sàng giai đoạn 3, Bộ Y tế và Hội đồng đạo đức trong nghiên cứu y sinh sẽ họp nghiệm thu kết quả giữa kỳ, nếu đạt, nhà sản xuất sẽ nộp hồ sơ đăng ký vắc xin.
Với Covivac và Arct-154, dự kiến sẽ hoàn tất các thử nghiệm vào cuối năm và dự kiến sản xuất chính thức từ năm 2022.
Vắc xin Covid-19 Covivac Việt Nam được đánh giá an toàn, dung nạp tốt
Covivac hiện là vắc xin ngừa Covid-19 thứ hai của Việt Nam đang thử nghiệm lâm sàng.
Chiều nay, Hội đồng Đạo đức trong nghiên cứu Y sinh học Quốc gia sẽ tiến hành họp để thông qua đề cương thử nghiệm lâm sàng giai đoạn 2 vắc xin Covid-19 Việt Nam Covivac.
Đây là thông tin được TS Dương Hữu Thái, Viện trưởng Viện Vắc xin và Sinh phẩm Y tế (Ivac), đơn vị phát triển vắc xin Covivac cho biết trong cuộc trao đổi với Dân trí ngày hôm nay.
Theo TS Thái, ngày 7/8, Hội đồng Đạo đức đã họp đánh giá kết quả thử nghiệm lâm sàng giữa kì giai đoạn một vắc xin Covivac và chấp thuận chuyển sang giai đoạn 2.
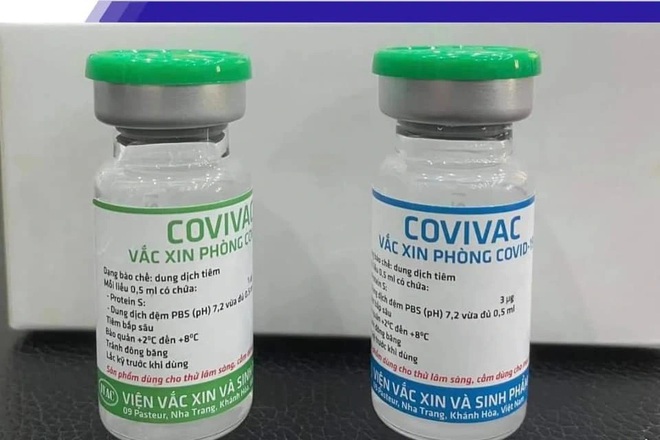
Vắc xin Covivac.
Theo báo cáo, trong giai đoạn một, vắc xin Covivac đã được thử nghiệm trên 120 người, trong độ tuổi 18-59 tuổi, phân bổ vào 4 nhóm thử, mỗi nhóm 25 người với các mức liều vắc xin: 1g, 3g, 10g và 1g 1,5mg tá chất CpG 1018, và nhóm giả dược có 20 người tiêm dung dịch muối đệm phosphat, pH=7,2.
Kết quả, tất cả 4 nhóm liều vắc xin an toàn, dung nạp tốt. Các phản ứng phụ sau tiêm hầu hết đều ở mức độ nhẹ, một tỷ lệ nhỏ ở mức độ vừa, tự chuyển biến hết sau 24h-48h. Phản ứng phổ biến nhất là đau tại vị trí tiêm. Có một trường hợp sốt 39,2 độ C vào ngày thứ 2 sau tiêm mũi 2, sau khi uống paracetamol thì hết sốt trong ngày và hai trường hợp khác sốt ở mức độ vừa.
Về đáp ứng miễn dịch, tất cả 4 nhóm mức liều khác nhau của vắc xin Covivac đều có đáp ứng miễn dịch kháng thể trung hòa SARS-CoV-2 và kháng thể IgG kháng protein S ở các mức độ khác nhau; cao nhất là nhóm 10g, tiếp đến là nhóm 1g tá chất, nhóm 3g, thấp nhất là nhóm 1g theo các biến số GMT, GMFR và tỷ lệ chuyển đổi huyết thanh tăng 4 lần và 10 lần so với trước khi tiêm.
Dựa trên kết quả này, nhóm nghiên cứu đề xuất mức liều 3g là lựa chọn hợp lý nhất trong bối cảnh sản xuất vắc xin cho đại dịch, đây là mức liều chuyển tiếp vào thử nghiệm lâm sàng giai đoạn 2. Ngoài ra Ivac bổ sung thêm một mức liều trung gian giữa 3 và 10g để thử ở giai đoạn 2.
Theo kế hoạch ban đầu, thử nghiệm lâm sàng giai đoạn 2 của vắc xin Covivac sẽ tiếp tục được thực hiện ở Thái Bình với khoảng 300 tình nguyện viên tham gia thử nghiệm.
"Các phương án triển khai thử nghiệm lâm sàng giai đoạn hai đều đã được xây dựng. Tuy nhiên, cần Hội đồng đạo đức phê duyệt mới có thể thành kế hoạch triển khai chính thức", TS Thái cho hay.
Nếu kế hoạch được thông qua, vào ngày mai đơn vị nghiên cứu có thể tiến hành thu tuyển tình nguyện viên cho thử nghiệm lâm sàng giai đoạn 2 vắc xin Covivac.
Vắc xin Covivac là dạng dung dịch chứa Protein S tái tổ hợp của SARS-CoV-2 biểu hiện trên bề mặt virus newcastle, bất hoạt, không có chất bảo quản, nhiệt độ bảo quản 2-8 độ C.
Vắc xin được sản xuất trên trứng gà có phôi, tinh khiết đạt 99% và bất hoạt bằng beta propiolactone. Covivac hiện là vắc xin ngừa Covid-19 thứ hai của Việt Nam đang thử nghiệm lâm sàng.
Tiêm thử nghiệm lâm sàng vắc xin phòng COVID-19 của Việt Nam tại Hưng Yên  Sáng 2/7, Học viện Quân y đã triển khai tiêm thử nghiệm đợt 2, giai đoạn 3 của vắc xin phòng COVID-19 Nano Covax của Việt Nam nghiên cứu và phát triển tại Hưng Yên. Vắc xin phòng COVID-19 Nano Covax do Công ty Nanogen nghiên cứu và phát triển, hiện đã bước sang giai đoạn 3 thử nghiệm lâm sàng. Đây là...
Sáng 2/7, Học viện Quân y đã triển khai tiêm thử nghiệm đợt 2, giai đoạn 3 của vắc xin phòng COVID-19 Nano Covax của Việt Nam nghiên cứu và phát triển tại Hưng Yên. Vắc xin phòng COVID-19 Nano Covax do Công ty Nanogen nghiên cứu và phát triển, hiện đã bước sang giai đoạn 3 thử nghiệm lâm sàng. Đây là...
 Xe Camry quay đầu giữa giao lộ thì "chạm trán" Lexus giá gần chục tỷ đồng00:36
Xe Camry quay đầu giữa giao lộ thì "chạm trán" Lexus giá gần chục tỷ đồng00:36 Công an xác minh clip người đàn ông khuyết tật bị hai thanh niên đi xe máy không mũ bảo hiểm tát vào đầu01:20
Công an xác minh clip người đàn ông khuyết tật bị hai thanh niên đi xe máy không mũ bảo hiểm tát vào đầu01:20 Nhân chứng bức xúc: Dù được xin lỗi, tài xế ô tô Lexus vẫn hành hung nam shipper10:09
Nhân chứng bức xúc: Dù được xin lỗi, tài xế ô tô Lexus vẫn hành hung nam shipper10:09 Lấn làn vượt ẩu, xe khách rúc vào đuôi xe ben, tự làm vỡ gương00:39
Lấn làn vượt ẩu, xe khách rúc vào đuôi xe ben, tự làm vỡ gương00:39 Thực hư clip xe cứu thương chế còi "cố lên, sắp tới rồi" chạy ở TPHCM00:28
Thực hư clip xe cứu thương chế còi "cố lên, sắp tới rồi" chạy ở TPHCM00:28 Điện thoại của Tangmo sau 3 năm ở Mỹ để lộ chi tiết sốc, người giữ máy khai gì?02:56
Điện thoại của Tangmo sau 3 năm ở Mỹ để lộ chi tiết sốc, người giữ máy khai gì?02:56 Đàn chim lạ nghìn con xuống phá ruộng lúa của người dân ở Hà Tĩnh01:07
Đàn chim lạ nghìn con xuống phá ruộng lúa của người dân ở Hà Tĩnh01:07 Ô tô đâm sập cửa nhà dân ở Thái Nguyên, cuốn người đàn ông vào gầm08:05
Ô tô đâm sập cửa nhà dân ở Thái Nguyên, cuốn người đàn ông vào gầm08:05 Xác minh clip 2 tài xế ô tô cầm kiếm dọa chém nhau giữa đường ở TPHCM00:52
Xác minh clip 2 tài xế ô tô cầm kiếm dọa chém nhau giữa đường ở TPHCM00:52 Tài xế xe Fortuner quyết không nhường đường xe cấp cứu vì "vướng" đèn đỏ01:28
Tài xế xe Fortuner quyết không nhường đường xe cấp cứu vì "vướng" đèn đỏ01:28 "Ép" hay "tự nguyện"? Làm rõ vụ việc phụ huynh 'tố' trường Mỗ Lao ép học thêm03:06
"Ép" hay "tự nguyện"? Làm rõ vụ việc phụ huynh 'tố' trường Mỗ Lao ép học thêm03:06Tiêu điểm
Tin đang nóng
Tin mới nhất

Kỳ lạ 1km đường có... 23 biển báo cấm đỗ xe

Tai nạn 6 người chết: Phần đuôi xe khách văng vào ô tô đầu kéo đi chiều ngược lại

Hiện trường vụ tai nạn giữa xe khách và xe đầu kéo khiến 6 người tử vong

Chủ shop "đau đầu" vì thông tin khách bị lộ, giả shipper lừa đảo tràn lan

Xác minh clip 2 tài xế ô tô cầm kiếm dọa chém nhau giữa đường ở TPHCM

Giải cứu cụ ông 78 tuổi khỏi căn nhà đang cháy ở Hà Nội

Hai đèn đỏ bất hợp lý liền nhau, cả ngã tư đứng im

Em gái mượn tên để đăng ký kết hôn, người chị bỗng có '2 chồng'

Ô tô 5 chỗ bị ép chặt giữa 2 xe container trên cầu Phú Mỹ, giao thông ùn ứ 2 giờ

Một công dân Thanh Hóa bị khống chế, cưỡng bức lao động tại Campuchia

Vụ công nhân muốn viết di chúc nhờ nhận tiền thôi việc: Đề xuất bất ngờ

Tàu chở 6 người bị sóng lớn đánh chìm trên biển Nha Trang
Có thể bạn quan tâm

Hành trình lật tẩy tội ác của kẻ sát hại vợ rồi phân xác phi tang xuống biển
Pháp luật
13:26:44 22/02/2025
Xem lại ảnh thời thơ ấu của chồng, người vợ nhận ra sự thật bất ngờ từ nhiều năm trước
Netizen
13:06:22 22/02/2025
Nên duyên vợ chồng sau tai nạn ô tô
Lạ vui
13:05:45 22/02/2025
Chuyện gì đã xảy ra khiến vợ Vũ Cát Tường cư xử lạ sau lễ thành đôi?
Sao việt
13:01:34 22/02/2025
Khán giả thực sự nói gì về Nữ Tu Bóng Tối: Một cái tên diễn hay hơn cả Song Hye Kyo?
Hậu trường phim
12:54:00 22/02/2025
Nóng: Thành viên Wonder Girls bị tố lừa đảo
Sao châu á
12:50:44 22/02/2025
Nữ rapper vừa "phá đảo" cùng Jennie: Quá khứ thất nghiệp, nghiện chất cấm nay là chủ nhân Grammy ở tuổi 27
Nhạc quốc tế
12:43:55 22/02/2025
Binz bị "bóc trần" điểm yếu theo cách không ngờ tới
Nhạc việt
12:05:22 22/02/2025
Sử dụng alpha arbutin làm trắng da như thế nào cho đúng?
Làm đẹp
11:48:38 22/02/2025
Cubarsi muốn học theo phong cách chơi của Van Dijk
Sao thể thao
11:28:43 22/02/2025
 Viettel Post tạm dừng giao nhận hàng tại Bắc Ninh vì liên quan nhiều ca COVID-19
Viettel Post tạm dừng giao nhận hàng tại Bắc Ninh vì liên quan nhiều ca COVID-19 F0 trong cộng đồng ở TP.HCM cao nhất 4 ngày qua, chiếm hơn 83% số ca mới
F0 trong cộng đồng ở TP.HCM cao nhất 4 ngày qua, chiếm hơn 83% số ca mới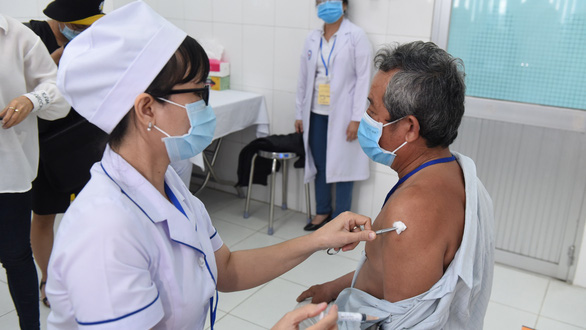
 Chuẩn bị thử nghiệm Covivac giai đoạn một
Chuẩn bị thử nghiệm Covivac giai đoạn một Hoàn thành thử nghiệm giai đoạn 1 vaccine ngừa COVID-19 Nano Covax
Hoàn thành thử nghiệm giai đoạn 1 vaccine ngừa COVID-19 Nano Covax Hơn 8 tỷ đồng hỗ trợ thử nghiệm vaccine Covivac
Hơn 8 tỷ đồng hỗ trợ thử nghiệm vaccine Covivac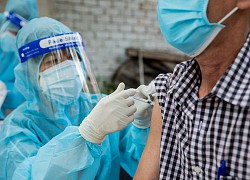 100 tình nguyện viên đầu tiên ở Hà Nội tiêm thử nghiệm vaccine COVID-19 ARCT-154
100 tình nguyện viên đầu tiên ở Hà Nội tiêm thử nghiệm vaccine COVID-19 ARCT-154 Nghiên cứu cắt giảm thủ tục cấp phép khẩn cấp cho vaccine Nano Covax
Nghiên cứu cắt giảm thủ tục cấp phép khẩn cấp cho vaccine Nano Covax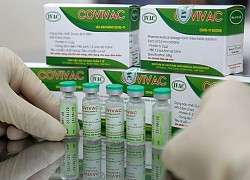 Tiến độ thử nghiệm 2 vaccine COVID-19 Nano Covax và Covivac của Việt Nam
Tiến độ thử nghiệm 2 vaccine COVID-19 Nano Covax và Covivac của Việt Nam Nhân chứng kể lại giây phút kinh hoàng vụ tai nạn 6 người chết ở Sơn La
Nhân chứng kể lại giây phút kinh hoàng vụ tai nạn 6 người chết ở Sơn La TP.HCM: Nam thanh niên rơi lầu 4 chung cư trong tình trạng không mặc quần áo
TP.HCM: Nam thanh niên rơi lầu 4 chung cư trong tình trạng không mặc quần áo Nam sinh lớp 10 nghi bị học sinh lớp 8 đánh gãy xương tay, chấn thương đầu
Nam sinh lớp 10 nghi bị học sinh lớp 8 đánh gãy xương tay, chấn thương đầu Tai nạn hy hữu, người đàn ông tử vong do lốp ô tô văng trúng
Tai nạn hy hữu, người đàn ông tử vong do lốp ô tô văng trúng
 Vụ tai nạn 6 người chết: Đường mưa trơn trượt, Cục CSGT khuyến cáo khẩn
Vụ tai nạn 6 người chết: Đường mưa trơn trượt, Cục CSGT khuyến cáo khẩn Xe khách va chạm ô tô đầu kéo, 6 người tử vong
Xe khách va chạm ô tô đầu kéo, 6 người tử vong Vụ vé số trúng 2 tỷ đồng bị từ chối trả thưởng: Chưa hòa giải chính thức
Vụ vé số trúng 2 tỷ đồng bị từ chối trả thưởng: Chưa hòa giải chính thức Người đàn ông chiếm đoạt tờ vé số trúng thưởng của cụ bà 83 tuổi
Người đàn ông chiếm đoạt tờ vé số trúng thưởng của cụ bà 83 tuổi Ngay khi biết chồng được thăng chức tăng lương, tôi làm một bữa thịnh soạn ăn mừng, nào ngờ anh tức giận hất đổ mâm cơm
Ngay khi biết chồng được thăng chức tăng lương, tôi làm một bữa thịnh soạn ăn mừng, nào ngờ anh tức giận hất đổ mâm cơm Sao nam Vbiz đang bị truy lùng chỉ vì 1 phát ngôn: Hot tới mức dính tin hẹn hò đồng giới lẫn yêu Hoa hậu!
Sao nam Vbiz đang bị truy lùng chỉ vì 1 phát ngôn: Hot tới mức dính tin hẹn hò đồng giới lẫn yêu Hoa hậu! Sao Việt 22/2: Thanh Hằng rủ chồng mỗi tuần tới một nhà hàng, Ý Nhi đẹp rạng rỡ
Sao Việt 22/2: Thanh Hằng rủ chồng mỗi tuần tới một nhà hàng, Ý Nhi đẹp rạng rỡ Trần Nghiên Hy - Cô gái vàng trong làng bê bối: 4 lần dính scandal làm "tiểu tam", 3 lần bị tố "cắm sừng" chồng
Trần Nghiên Hy - Cô gái vàng trong làng bê bối: 4 lần dính scandal làm "tiểu tam", 3 lần bị tố "cắm sừng" chồng 1 tuần nữa có 2 con giáp gặp thời đổi vận, tài khoản liên tục tăng số, 1 con giáp thận trọng
1 tuần nữa có 2 con giáp gặp thời đổi vận, tài khoản liên tục tăng số, 1 con giáp thận trọng Vụ tai nạn 6 người chết ở Sơn La: Khởi tố vụ án
Vụ tai nạn 6 người chết ở Sơn La: Khởi tố vụ án U45 đang làm kế toán thì đột ngột mất việc, chuyển sang nghề lao công lại gặp ngay ông sếp xấu tính, đến ngày nhận lương mà tức trào nước mắt
U45 đang làm kế toán thì đột ngột mất việc, chuyển sang nghề lao công lại gặp ngay ông sếp xấu tính, đến ngày nhận lương mà tức trào nước mắt Taxi đi nhầm đường, nữ sinh nhảy ra khỏi xe vì tưởng mình bị bắt cóc rồi bị đâm tử vong: Tòa tuyên án ra sao với tài xế?
Taxi đi nhầm đường, nữ sinh nhảy ra khỏi xe vì tưởng mình bị bắt cóc rồi bị đâm tử vong: Tòa tuyên án ra sao với tài xế? Thảm cảnh của ác nữ đẹp nhất màn ảnh: Nghèo túng đến nỗi phải nhặt đồ ăn thừa, nhan sắc tụt dốc thê thảm không nhận ra
Thảm cảnh của ác nữ đẹp nhất màn ảnh: Nghèo túng đến nỗi phải nhặt đồ ăn thừa, nhan sắc tụt dốc thê thảm không nhận ra 'Diễn viên Đình Thế mất ở tuổi 22 mà không kịp nói lời trăng trối'
'Diễn viên Đình Thế mất ở tuổi 22 mà không kịp nói lời trăng trối' Vụ thi thể không nguyên vẹn: Lời khai rợn người của gã chồng giết vợ
Vụ thi thể không nguyên vẹn: Lời khai rợn người của gã chồng giết vợ Chấn động tin em rể đại gia lợi dụng cái chết Từ Hy Viên công khai có con riêng, danh tính "tiểu tam" lộ diện
Chấn động tin em rể đại gia lợi dụng cái chết Từ Hy Viên công khai có con riêng, danh tính "tiểu tam" lộ diện Vợ 3 kém 29 tuổi nhắc Bảo Chung: "Quãng đời còn lại đừng có ai nữa nhé!"
Vợ 3 kém 29 tuổi nhắc Bảo Chung: "Quãng đời còn lại đừng có ai nữa nhé!" Một phụ nữ bị bố của người tình thuê côn đồ tạt axit, đánh gãy chân
Một phụ nữ bị bố của người tình thuê côn đồ tạt axit, đánh gãy chân Vụ cụ ông tử vong dưới sông ở An Giang: Bắt giữ nghi phạm giết người
Vụ cụ ông tử vong dưới sông ở An Giang: Bắt giữ nghi phạm giết người Hoa hậu Việt Nam nghi sắp làm phu nhân hào môn lộ hint rời Sen Vàng?
Hoa hậu Việt Nam nghi sắp làm phu nhân hào môn lộ hint rời Sen Vàng? Giết vợ rồi phân xác làm 3 phần phi tang xuống biển
Giết vợ rồi phân xác làm 3 phần phi tang xuống biển