Vaccine Nano Covax – Bao giờ và tại sao?
Nano Covax của Nanogen đang nghiên cứu lâm sàng giai đoạn 3, đã được Hội đồng đạo đức thông qua, nhưng để được cấp phép vacicne này cần đạt yêu cầu thế nào?
Sau khi được Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia (Hội đồng đạo đức) thông qua báo cáo giữa kỳ giai đoạn 3, toàn bộ hồ sơ, dữ liệu của vaccine Nano Covax chuyển sang thường trực Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Hội đồng tư vấn) xem xét trước khi trình Bộ Y tế đề xuất cấp phép khẩn cấp.
Tiến độ thử nghiệm Nano Covax
Theo TS Nguyễn Ngô Quang, Phó Cục trưởng Cục Khoa học công nghệ và Đào tạo (Bộ Y tế), Chánh Văn phòng Chương trình Quốc gia nghiên cứu phát triển vaccine, Nano Covax đã hoàn tất thử nghiệm lâm sàng giai đoạn 3.
Giai đoạn này có 13.000 tình nguyện viên tham gia thử nghiệm. Tại miền Bắc, vaccine thử nghiệm ở Học viện Quân y và Hưng Yên; còn phía Nam là Viện Pasteur TP.HCM và Long An. Các tình nguyện viên chia làm 2 nhóm. Nhóm 1 tiêm liều 25 mcg và nhóm 2 tiêm giả dược với thành phần tá dược nhôm.
Giai đoạn 1, 2 vaccine Nano Covax bước đầu được đánh giá an toàn, khả năng sinh miễn dịch tốt, đặc biệt là với liều lượng 25 mcg. Giai đoạn 3, nhóm nghiên cứu sẽ có dữ liệu đánh giá về tính an toàn, khả năng sinh miễn dịch và hiệu quả của vaccine với các biến chủng được phát hiện lần đầu ở Anh, Nam Phi. Ở giai đoạn này, tác dụng của vaccine với biến thể của SARS-CoV-2 tìm thấy lần đầu tại Ấn Độ cũng sẽ được nghiên cứu, đánh giá.
Vaccine Nano Covax của Nanogen và Học viện Quân y phối hợp nghiên cứu, sản xuất.
Theo đại diện Học viện Quân y, đơn vị phối hợp nghiên cứu, sản xuất vaccine với Nanogen, ở giai đoạn 3, nhóm nghiên cứu so sánh kháng thể bảo vệ ở người tiêm Nano Covax với bệnh nhân mắc COVID-19 đã khỏi bệnh. Kết quả, sau 42 ngày lượng kháng thể của người tiêm mũi 1 vaccine Nano Covax cao hơn gấp nhiều lần so với người từng mắc COVID-19 đã khỏi bệnh.
Qua cả 3 giai đoạn, Nano Covax được đánh giá là an toàn, sinh miễn dịch tốt. Ở giai đoạn 1, không có người phản ứng phản vệ độ 1. Trong khi đó, giai đoạn 2 và 3, nhóm nghiên cứu chỉ ghi nhận 1 tình nguyện viên bị phản vệ độ 2, còn lại đều là phản ứng thông thường như sốt nhẹ, sưng đau vết tiêm… Tính theo tỷ lệ thì cán phản ứng thông thường từ nặng tới nhẹ của Nano Covax đều thấp hơn với các vaccine đang lưu hành hiện nay.
Với những kết quả đó, nhóm nghiên cứu đã nộp hồ sơ lên Hội đồng đạo đức để đánh giá, xét duyệt trước khi được xem xét cấp phép khẩn cấp.
Theo Bộ Y tế, với vaccine COVID-19 sản xuất trong nước đang thử nghiệm lâm sàng nếu có kết quả đánh giá giữa kỳ giai đoạn 3 về tính an toàn và hiệu quả bảo vệ dựa trên dữ liệu về tính sinh miễn dịch thì được sử dụng để xem xét cấp giấy đăng ký lưu hành có điều kiện. Nano Covax cũng vậy. Việc này thực hiện trên cơ sở ý kiến tư vấn của Hội đồng đạo đức và Hội đồng tư vấn.
Như vậy, sau khi Nano Covax được Hội đồng đạo đức chấp thuận kết quả thử nghiệm lâm sàng giữa giai đoạn 3, hồ sơ và dữ liệu nghiên cứu của vaccine sẽ chuyển sang Hội đồng tư vấn tiếp tục xem xét.
Sau khi có biên bản nghiệm thu kết quả thử nghiệm và nghiên cứu liên quan tới Nano Covax, Hội đồng tư vấn sẽ họp xem xét cấp phép.
Video đang HOT
Trong thời hạn tối đa 20 ngày làm việc kể từ ngày nhận đủ hồ sơ, Cục trưởng Cục Quản lý Dược cấp giấy đăng ký lưu hành vaccine.
Trường hợp Nano Covax không cấp hoặc chưa cấp, Cục Quản lý Dược sẽ ra văn bản thông báo và nêu rõ lý do. Nếu cần tài liệu bổ sung thì Cục Quản lý Dược sẽ có văn bản phản hồi đơn vị đăng ký. Thời hạn là 36 tháng với trường hợp yêu cầu bổ sung tài liệu tiền lâm sàng và lâm sàng, tài liệu nghiên cứu độ ổn định; thời hạn 12 tháng với trường hợp bổ sung tài liệu khác. Sau thời hạn này, cơ sở đăng ký không nộp tài liệu bổ sung thì hồ sơ đã nộp không còn giá trị.
Cơ sở đăng ký thông báo bằng văn bản về Cục Quản lý Dược trường hợp nếu thông tin cập nhật liên quan đến an toàn, hiệu quả của vaccine so với hồ sơ đăng ký đã nộp và đang trong thời gian thẩm định. Thời gian kể từ khi có văn bản thông báo của Cục Quản lý dược đến khi cơ sở đăng ký nộp tài liệu bổ sung không được tính vào thời hạn quy định kể trên.
Trong thời hạn 15 ngày làm việc kể từ ngày nhận đủ tài liệu bổ sung, Cục trưởng Cục Quản lý Dược quyết định cấp giấy đăng ký lưu hành đối với hồ sơ đạt yêu cầu. Cục Quản lý Dược cũng sẽ có văn bản thông báo theo kết luận của Hội đồng Tư vấn đối với hồ sơ thẩm định chưa đạt, không đạt và nêu rõ lý do.
Thời gian để cấp giấy đăng ký cho một loại vaccine đủ điều kiện lưu hành là 20 ngày. Tuy nhiên, nếu vaccine Nano Covax đảm bảo mọi yêu cầu đặt ra, thời gian cấp phép có thể ngắn hơn, thậm chí chỉ dưới 1 tuần.
Như vậy, sau khi được Hội đồng đạo đức chấp thuận, Hội đồng tư vấn thông qua hồ sơ, báo cáo và đề xuất với Cục Quản lý Dược (Bộ Y tế), vaccine Nano Covax sẽ được xem xét, đánh giá cấp phép khẩn cấp.
Theo PGS. TS Lê Văn Truyền, Chủ tịch Hội đồng tư vấn, quá trình cấp phép vaccine Nano Covax của Việt Nam không cần “xin” ý kiến của Tổ chức Y tế Thế giới (WHO). “Đây là câu chuyện của Việt Nam, cấp hay không là quyền của chúng ta mà cụ thể là Bộ Y tế. Tuy nhiên, quá trình cấp phép, chúng ta có thể tham khảo thêm các chuyên gia của WHO về chuyên môn vì họ có nhiều kinh nghiệm trong lĩnh vực này”, vị này nói.
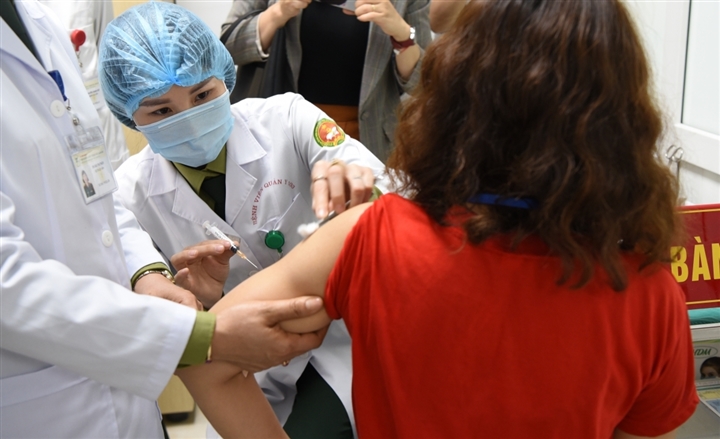
Tình nguyện viên thử nghiệm vaccine Nano Covax.
Khả năng nào cho Nano Covax?
Trong 3 ngày, từ 20/8 đến 22/8, sau khi xem xét, đánh giá hồ sơ và báo cáo, Hội đồng đạo đức họp và thống nhất chấp nhận kết quả thử nghiệm lâm sàng giai đoạn 3a với Nano Covax. Sau đó, hồ sơ và dữ liệu nghiên cứu của vaccine này được chuyển sang Hội đồng tư vấn để xem xét trước khi Bộ Y tế quyết định cấp phép khẩn cấp có điều kiện.
Ngày 29/8, Hội đồng tư vấn họp, nhưng chưa đồng ý thông qua vì hồ sơ thiếu một số nội dung. Hội đồng yêu cầu Nanogen và nhóm nghiên cứu tiếp tục bổ sung, làm rõ nội dung về chất lượng; hồ sơ dược lý, lâm sàng; tính an toàn; tính sinh miễn dịch và hiệu quả bảo vệ.
Ngày 1/9, Công ty Nanogen thông tin đã bổ sung hồ sơ và báo cáo cho Hội đồng đạo đức xem xét, đánh giá.
Trong cuộc họp đánh giá kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 vaccine Nano Covax (với kết quả nghiên cứu tính đến ngày 2/9) diễn ra ngay sau đó, Hội đồng đạo đức tiếp tục thông qua dữ liệu báo cáo bổ sung của Nanogen.
Theo kết luận, Nano Covax đạt yêu cầu về tính an toàn trong ngắn hạn dựa trên dữ liệu báo cáo kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 tính đến thời điểm hiện tại (kết quả theo dõi 7 ngày sau tiêm mũi 1 của 11,430 người tình nguyện; kết quả theo dõi 7 ngày sau tiêm mũi 2 của 5.785 người tình nguyện).
Vaccine của Nanogen cũng có tính sinh miễn dịch dựa trên kết quả xét nghiệm nồng độ kháng thể Anti-S IgG trên 924 mẫu ngày 42 sau tiêm mũi 1; kết quả xét nghiệm hoạt tính trung hòa virus trên 761 mẫu ngày 42 sau tiêm mũi 1; kết quả trung bình nhân hiệu giá kháng thể trung hòa PRNT ngày 42 sau tiêm mũi 1 trên 107 mẫu chủng Vũ Hán; 41 mẫu chủng Delta; 39 mẫu chủng Alpha).
Tuy nhiên, về hiệu lực bảo vệ (kết quả quan trọng nhất về chất lượng) thì tới thời điểm đó, vaccine Nano Covax vẫn chưa có dữ liệu để đánh giá trực tiếp dựa trên số trường hợp mắc COVID-19 trong nghiên cứu. Do vậy, nhóm nghiên cứu cần tiếp tục thực hiện đánh giá về hiệu lực bảo vệ theo đề cương được phê duyệt.
Ngoài ra, nhóm nghiên cứu cũng cần ước tính hiệu quả bảo vệ của Nano Covax dựa trên dữ liệu về tính sinh miễn dịch của vaccine nghiên cứu đảm bảo tính khoa học để chuyển hồ sơ tới Hội đồng tư vấn xem xét.
Hội đồng đạo đức cũng đề nghị Nanogen và nhóm nghiên cứu hoàn thiện báo cáo theo kết luận của cuộc họp và tiếp tục triển khai bảo đảm chất lượng, tiến độ nghiên cứu thử nghiệm lâm sàng vaccine Nano Covax theo đề cương đã được phê duyệt để hoàn tất nghiên cứu vào tháng 3/2022. Đơn vị nghiên cứu cũng cần cập nhật kịp thời kết quả nghiên cứu cho các Hội đồng chuyên môn và cơ quan quản lý.
Vì sao bệnh nhân dùng thuốc kháng virus Molnupiravir phải ký hợp đồng?
Thuốc Molnupiravir chưa được cấp phép nên khi sử dụng, F0 phải ký hợp đồng tham gia nghiên cứu lâm sàng.
Quy trình sử dụng 3 túi thuốc điều trị Covid-19 cho F0 tại nhà là nội dung được bà Phạm Khánh Phong Lan, Chủ tịch Hội Dược học TP.HCM, giải thích chi tiết tại buổi họp báo cung cấp thông tin về dịch Covid-19 chiều 30/8.
Được giao điều phối việc phân phối các túi thuốc này, bà Lan cho biết túi thuốc cho F0 điều trị tại nhà được chia thành 3 gói (A, B, C). Gói A là những thuốc thông dụng gồm thuốc hạ sốt và vitamin nâng cao thể trạng. Gói B là những thuốc sử dụng hạn chế một số tình huống đặc biệt gồm thuốc kháng viêm và thuốc kháng đông. Gói C là thuốc kháng virus Molnupiravir dùng cho F0 có triệu chứng nhẹ và được kiểm soát đặc biệt
TP.HCM được phân bổ 50.000 liều Molnupiravir
Molnupiravir trong gói thuốc C là sản phẩm được hãng dược phẩm Merck của Mỹ và Công ty Ridgeback của Đức nghiên cứu phát triển, nhằm điều trị Covid-19 cho bệnh nhân từ nhẹ đến trung bình. Theo Chủ tịch Hội Dược học TP.HCM, thuốc Molnupiravir chưa được cấp phép. Công ty TNHH Liên doanh Stellapharm Việt Nam được nhượng quyền khai thác và sản xuất. Doanh nghiệp này đang làm hồ sơ trình Bộ Y tế.
Thông tin với báo chí, bà Lan cho biết thuốc Molnupiravir đã được thử nghiệm lâm sàng. Công ty Stellapharm sẽ tài trợ cho Việt Nam 2,3 triệu viên, tương đương 116.000 liều.
Lực lượng y tế chăm sóc F0 điều trị tại nhà. Ảnh: Phạm Ngôn.
Về cách sử dụng 3 túi thuốc, bà Phạm Khánh Phong Lan cho biết thuốc trong túi A và túi B chỉ điều trị thể trạng, triệu chứng. Tới nay, Sở Y tế TP.HCM đã chuẩn bị 150.000 túi thuốc A và B. Khoảng 74.000 túi đã được giao về Trung tâm y tế quận, huyện để đưa xuống phường, xã. Số còn lại đang được tích trữ tại Bệnh viện Nhi đồng 1.
Đến ngày 23/8, TP.HCM có 21.093 ca F0 đang điều trị tại nhà nên bà Lan khẳng định túi thuốc A và B đủ để phát cho bệnh nhân.
Về túi thuốc C, Chủ tịch Hội Dược học TP.HCM lý giải đây là công trình nghiên cứu của Bộ Y tế. Trong 116.000 liều được Stellapharm tài trợ, Bộ Y tế đã phân bổ cho TP.HCM 50.000 liều. Thành phố hiện mới nhận 16.000 liều nên việc đưa xuống địa phương có thể thiếu. Còn 34.000 liều còn lại sẽ được bổ sung ngày 31/8 hoặc 1/9.
Bà Lan khẳng định điều thuận lợi là công ty sản xuất thuốc có trụ sở ngay tại TP.HCM nên không mất công chuyên trở. Một lợi thế khác là thuốc này do doanh nghiệp tại Việt Nam tự sản xuất nên chủ động, không lâm vào tình trạng "có tiền không mua được" như vaccine. Công ty tại Việt Nam là một trong những doanh nghiệp hiếm hoi được nhượng quyền sản xuất ngay tại chỗ.
Ngoài thuốc này, Tập đoàn Vingroup còn tài trợ 500.000 liều Remdesivir của Mỹ. Bộ Y tế đã phân bổ cho TP.HCM 70.000 liều nhưng thuốc này không dùng ngoại trú nên được phân bổ cho các bệnh viện điều trị tầng 3 nhằm hồi sức cấp cứu đặc biệt cho bệnh nhân nặng.
F0 là đối tượng nghiên cứu khi dùng Molnupiravir
Chủ tịch Hội Dược học TP.HCM lý giải Molnupiravir là thuốc nhượng quyền sản xuất nên đòi hỏi có nghiên cứu về lâm sàng, tác dụng phụ. Thuốc được nghiên cứu tại Bệnh viện Thống Nhất và cho kết quả khả quan. Khi F0 sử dụng, họ được xem như đối tượng nghiên cứu.
Khi túi thuốc này được bàn giao cho cơ quan y tế để cấp chi F0 điều trị tại nhà, bệnh nhân phải ký hợp đồng tham gia nghiên cứu, trong đó quy định phải rõ ràng trường hợp nào được sử dụng.
Cụ thể, F0 được dùng Molnupiravir là người test nhanh hoặc PCR dương tính, xác định là người mang virus mới sử dụng thuốc diệt virus. F0 này phải ở thể nhẹ, nhịp thở dưới 20 lần/phút, nồng độ oxy (SpO2) cao hơn 96%.
Mỗi túi thuốc C sẽ chứa 5 ngày thuốc. Mỗi ngày 4 viên, chia làm 2 lần uống. Bà Lan cho biết kết quả nghiên cứu cho thấy sau 5 ngày, bệnh nhân có sự cải thiện rõ rệt, nồng độ virus có thể giảm, hướng đến âm tính.
F0 phải thường xuyên theo dõi tình trạng bằng máy đo SpO2. Ảnh: Phạm Ngôn.
"Túi thuốc A ai cũng nên dùng. Tuy nhiên, nhiều người lầm tưởng rằng xong túi A thì uống đến túi B, C là không đúng", bà Lan nhấn mạnh.
Phạm Khánh Phong Lan cho biết túi A dùng bình thường. Túi C nếu đủ điều kiện và đã ký hợp đồng thì dùng ngay để giảm nồng độ virus. Nếu dùng túi C rồi nhưng trong quá trình dùng lại trở nặng, có nhịp thở trên 30 lần/phút, nồng độ oxi (SpO2) dưới 95%, thì phải gọi nhân viên y tế. Trong lúc chờ cán bộ y tế tới, bệnh nhân có thể dùng túi B (thuốc kháng viêm và kháng đông).
Tuy nhiên, túi B chỉ được dùng tối đa 3 ngày. Túi này phải dùng ngay để giải quyết triệu chứng trước mắt. Bà Phạm Khánh Phong Lan khuyến cáo F0 không dùng song song túi thuốc B và túi thuốc C.
"Không dùng kháng đông và Molnupiravir song song vì như vậy rất nguy hiểm", Chủ tịch Hội Dược học TP.HCM nói và lưu ý thêm trong túi B và túi C có một số loại chống chỉ định như phụ nữ có thai, cho con bú, suy thận, suy gan, tiền sử bệnh đông máu...
Trước đó, Sở Y tế TP.HCM đã có túi thuốc điều trị Covid-19 cho F0 tại nhà được chia thành 3 gói (A, B, C), sử dụng tùy thuộc vào triệu chứng của bệnh nhân. Gói A là những thuốc thông dụng gồm thuốc hạ sốt và vitamin nâng cao thể trạng.
Gói B là những thuốc sử dụng hạn chế một số tình huống đặc biệt gồm thuốc kháng viêm và thuốc kháng đông. Thời gian F0 tự uống không quá 3 ngày, trong thời gian này người bệnh cần phải tiếp tục liên hệ bác sĩ để được hỗ trợ, tùy tình trạng sức khỏe của người bệnh, bác sĩ sẽ quyết định cho người bệnh dùng tiếp thuốc này cho đủ 7 ngày.
Gói C là thuốc kháng virus Molnupiravir dùng cho F0 có triệu chứng nhẹ và được kiểm soát đặc biệt. Theo đó, thuốc Molnupiravir uống 2 lần/ngày trong 5 ngày liên tục.
Vì sao vaccine Covid-19 được chuyển giao công nghệ khi chưa cấp phép?  Chuyển giao công nghệ cho các quốc gia trước khi vaccine Covid-19 được cấp phép không phải điều lạ. Thậm chí, nhiều vaccine đã được đặt mua số lượng lớn trước khi được chấp thuận. Sau thời gian thử nghiệm lâm sàng trên tổng cộng hơn 14.000 người ở giai đoạn 3, Nano Covax đã được Hội đồng Đạo đức thông qua báo...
Chuyển giao công nghệ cho các quốc gia trước khi vaccine Covid-19 được cấp phép không phải điều lạ. Thậm chí, nhiều vaccine đã được đặt mua số lượng lớn trước khi được chấp thuận. Sau thời gian thử nghiệm lâm sàng trên tổng cộng hơn 14.000 người ở giai đoạn 3, Nano Covax đã được Hội đồng Đạo đức thông qua báo...
 Thực hư tin Campuchia điều binh sĩ tới biên giới với Thái Lan sau vụ đối đầu08:43
Thực hư tin Campuchia điều binh sĩ tới biên giới với Thái Lan sau vụ đối đầu08:43 Xung đột Nga - Ukraine trước bước ngoặt08:59
Xung đột Nga - Ukraine trước bước ngoặt08:59 Vụ trộm bồn cầu làm bằng 98 kg vàng: nghi phạm ra tay trong 5 phút09:08
Vụ trộm bồn cầu làm bằng 98 kg vàng: nghi phạm ra tay trong 5 phút09:08 Báo Mỹ: Ông Trump "khó chịu" vì trang phục của ông Zelensky01:28
Báo Mỹ: Ông Trump "khó chịu" vì trang phục của ông Zelensky01:28 Ông Trump khen ông Zelensky dũng cảm, không cam kết hỗ trợ lực lượng châu Âu tại Ukraine08:00
Ông Trump khen ông Zelensky dũng cảm, không cam kết hỗ trợ lực lượng châu Âu tại Ukraine08:00 Phát sốt đoạn phim ông Trump, ông Netanyahu nhâm nhi cocktail ở bãi biển Gaza08:01
Phát sốt đoạn phim ông Trump, ông Netanyahu nhâm nhi cocktail ở bãi biển Gaza08:01 Không chỉ Mỹ, Pháp cũng đàm phán về khoáng sản quan trọng với Ukraine09:14
Không chỉ Mỹ, Pháp cũng đàm phán về khoáng sản quan trọng với Ukraine09:14 Xe mất thắng lao xuống rãnh ven đường, ít nhất 18 người thiệt mạng tại Thái Lan01:07
Xe mất thắng lao xuống rãnh ven đường, ít nhất 18 người thiệt mạng tại Thái Lan01:07 Đột ngột chuyển sai hướng, ô tô gây tai nạn liên hoàn ở Đắk Lắk00:50
Đột ngột chuyển sai hướng, ô tô gây tai nạn liên hoàn ở Đắk Lắk00:50 Ông Trump nổi giận, tương lai nào đang chờ đón ông Zelensky và Ukraine?01:38
Ông Trump nổi giận, tương lai nào đang chờ đón ông Zelensky và Ukraine?01:38 Ông Tập Cận Bình nói kinh tế Trung Quốc đang đối mặt nhiều thách thức08:09
Ông Tập Cận Bình nói kinh tế Trung Quốc đang đối mặt nhiều thách thức08:09Tiêu điểm
Tin đang nóng
Tin mới nhất

5 món tuyệt đối không nên ăn vào buổi tối
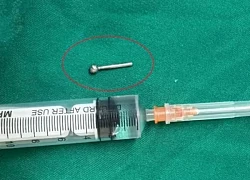
Khuyên lưỡi rơi vào dạ dày khi ăn cơm
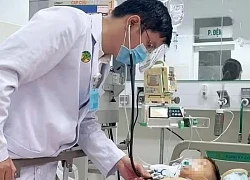
Bé trai 6 tuổi nguy kịch vì điện giật khi đang chơi đùa

Nhiều phụ nữ mang thai nhiễm cúm, hệ lụy ra sao?
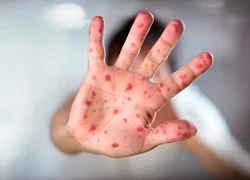
Bé gái phổi đông đặc do mắc cúm A và sởi: vì sao bệnh sởi ở trẻ có diễn biến nhanh và nặng?

Vì sao khoai lang được mệnh danh là siêu thực phẩm?

5 loại rau là kho canxi giúp xương chắc khỏe cho độ tuổi trung niên

Đồ uống giúp xương khớp chắc khỏe trong mùa đông

Tin vui cho những người có thói quen ăn gừng và uống trà gừng

Bài thuốc từ cá ngựa bổ dưỡng, tăng cường sức khỏe

Nhiễm nấm đường ruột nguy hiểm như nào?

Ai không nên uống trà hoa cúc táo đỏ?
Có thể bạn quan tâm

Những món ngon nhất định phải thử khi đến Bắc Ninh
Ẩm thực
06:02:00 05/03/2025
Phim cổ trang 18+ bị ném đá vì toàn cảnh nóng vô duyên, nữ chính xinh như công chúa cũng không cứu nổi
Phim châu á
06:00:57 05/03/2025
Quá trình 'phong ấn nhan sắc' của trai đẹp Bill Skarsgrd thành ma cà rồng: 6 tiếng trang điểm, 62 bộ phận giả
Hậu trường phim
05:58:55 05/03/2025
Ngăn bạo lực trong ngày ra phán quyết về vụ luận tội Tổng thống Yoon Suk Yeol
Thế giới
05:54:18 05/03/2025
Bom tấn mới ra mắt gây chia rẽ game thủ, rating siêu tệ nhưng người chơi lại quá đông
Mọt game
05:36:39 05/03/2025
Xuất hiện tại một sự kiện Cosplay, game Gacha toàn "gái xinh" sắp được phát hành tại Việt Nam, nghi vấn được hẳn một "ông lớn" hậu thuẫn
Cosplay
05:34:06 05/03/2025
Mẹ chồng suốt ngày chì chiết con dâu hoang phí, tôi đưa ra một bằng chứng khiến bà chết lặng!
Góc tâm tình
05:27:21 05/03/2025
Bác sĩ báo tin vui cho Xuân Son
Sao thể thao
00:52:45 05/03/2025
Những câu thoại đầy ý nghĩa trong bộ phim 'Nhà gia tiên'
Phim việt
23:37:10 04/03/2025
Câu trả lời của Trương Mỹ Nhân trước nghi vấn rạn nứt với Phí Ngọc Hưng
Sao việt
23:10:00 04/03/2025
 F0 xin bác sĩ ‘không điều trị nữa’
F0 xin bác sĩ ‘không điều trị nữa’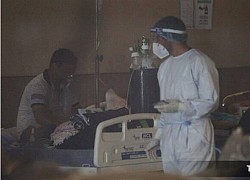 COVID-19 có liên quan đến giảm cân và suy dinh dưỡng?
COVID-19 có liên quan đến giảm cân và suy dinh dưỡng?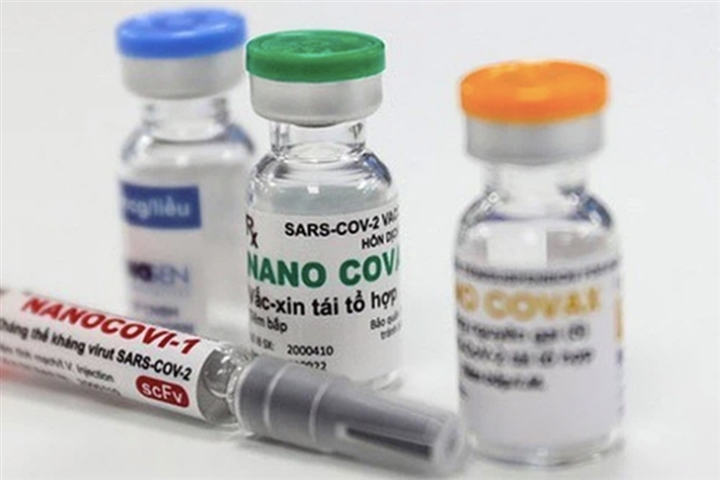

 Đối tác Ấn Độ hợp tác với Nanogen thử nghiệm, sản xuất vắc xin Nanocovax
Đối tác Ấn Độ hợp tác với Nanogen thử nghiệm, sản xuất vắc xin Nanocovax Sắp đánh giá kết quả giai đoạn 2 của vacine Nano Covax
Sắp đánh giá kết quả giai đoạn 2 của vacine Nano Covax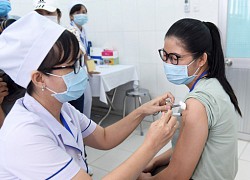 Vắc xin Nano Covax có cả dạng xịt mũi
Vắc xin Nano Covax có cả dạng xịt mũi TPHCM sắp được cấp một triệu viên xuyên tâm liên hỗ trợ điều trị Covid-19
TPHCM sắp được cấp một triệu viên xuyên tâm liên hỗ trợ điều trị Covid-19 Liệu pháp mới trị bệnh bạch cầu tế bào tóc
Liệu pháp mới trị bệnh bạch cầu tế bào tóc Loại thuốc tránh thai mới dành cho nam giới
Loại thuốc tránh thai mới dành cho nam giới Các món là 'vua phá dạ dày' nhiều người vẫn ăn uống vô tư
Các món là 'vua phá dạ dày' nhiều người vẫn ăn uống vô tư Nguy cơ từ trào lưu ăn đồ sống
Nguy cơ từ trào lưu ăn đồ sống Nhịn ăn gián đoạn kéo dài có hại gì?
Nhịn ăn gián đoạn kéo dài có hại gì? Việt Nam có một 'thần dược' chống ung thư, kéo dài tuổi thọ, cứ ra chợ ra thấy
Việt Nam có một 'thần dược' chống ung thư, kéo dài tuổi thọ, cứ ra chợ ra thấy Biểu hiện nhiễm vi khuẩn tụ cầu vàng
Biểu hiện nhiễm vi khuẩn tụ cầu vàng Có nên ăn trứng kết hợp uống sữa trong bữa sáng?
Có nên ăn trứng kết hợp uống sữa trong bữa sáng? 5 không khi ăn xôi
5 không khi ăn xôi 9 lợi ích khi ăn 1 quả ổi mỗi ngày
9 lợi ích khi ăn 1 quả ổi mỗi ngày Lý giải "Bắc Bling" gây sốt toàn cầu: Khi ca sĩ là sứ giả du lịch
Lý giải "Bắc Bling" gây sốt toàn cầu: Khi ca sĩ là sứ giả du lịch Chuyện gì đang xảy ra với Quán quân hot nhất Gương Mặt Thân Quen?
Chuyện gì đang xảy ra với Quán quân hot nhất Gương Mặt Thân Quen? Đạo diễn nói về chi tiết tranh luận của nghệ sĩ Xuân Hinh trong 'Bắc Bling'
Đạo diễn nói về chi tiết tranh luận của nghệ sĩ Xuân Hinh trong 'Bắc Bling' Bí ẩn về mối quan hệ của Từ Hy Viên và mẹ chồng Hàn Quốc đã được giải đáp
Bí ẩn về mối quan hệ của Từ Hy Viên và mẹ chồng Hàn Quốc đã được giải đáp Mẹ vợ đến nhà chơi, chồng tôi đã bưng ra đĩa rau luộc và đĩa cá, mẹ tôi vừa ngửi qua thì nổi giận đùng đùng
Mẹ vợ đến nhà chơi, chồng tôi đã bưng ra đĩa rau luộc và đĩa cá, mẹ tôi vừa ngửi qua thì nổi giận đùng đùng Cú 'ngã ngựa' của ông hoàng phòng vé Nguyễn Quang Dũng
Cú 'ngã ngựa' của ông hoàng phòng vé Nguyễn Quang Dũng Hòa Minzy cảnh báo gấp
Hòa Minzy cảnh báo gấp Bà ngoại mất để lại cho tôi chiếc bếp từ và cái tủ lạnh, không ngờ 2 món thừa kế vô dụng ấy lại khiến tôi "đổi đời" sau một đêm
Bà ngoại mất để lại cho tôi chiếc bếp từ và cái tủ lạnh, không ngờ 2 món thừa kế vô dụng ấy lại khiến tôi "đổi đời" sau một đêm
 Thái độ Xuân Hinh dành cho Hòa Minzy
Thái độ Xuân Hinh dành cho Hòa Minzy Cuộc hôn nhân ngắn nhất showbiz: Sao nữ bị chồng đánh sảy thai rồi vứt trên đường, ly dị sau 12 ngày cưới
Cuộc hôn nhân ngắn nhất showbiz: Sao nữ bị chồng đánh sảy thai rồi vứt trên đường, ly dị sau 12 ngày cưới

 Cục trưởng Xuân Bắc nói gì về Hòa Minzy mà gây bão mạng?
Cục trưởng Xuân Bắc nói gì về Hòa Minzy mà gây bão mạng? Thấy có nhiều chim lợn, trường mua vàng mã, mời thầy về cúng!
Thấy có nhiều chim lợn, trường mua vàng mã, mời thầy về cúng! Chiến sĩ cảnh sát cơ động bị đâm tử vong: Hiền, siêng năng, giỏi tiếng Anh
Chiến sĩ cảnh sát cơ động bị đâm tử vong: Hiền, siêng năng, giỏi tiếng Anh Không chỉ riêng Văn Toàn, Hoà Minzy còn vay tiền Đoàn Văn Hậu, thân cỡ nào mà mượn tiền tỷ ngon ơ?
Không chỉ riêng Văn Toàn, Hoà Minzy còn vay tiền Đoàn Văn Hậu, thân cỡ nào mà mượn tiền tỷ ngon ơ? Bố mẹ vợ Quang Hải mang đặc sản thiết đãi thông gia, một mình Chu Thanh Huyền ngồi đất ăn món bình dân gây sốt
Bố mẹ vợ Quang Hải mang đặc sản thiết đãi thông gia, một mình Chu Thanh Huyền ngồi đất ăn món bình dân gây sốt