Thanh niên trẻ bị mốc đen mọc thành mảng trong não
Một cư dân trẻ tuổi ở Rhode Island đã mắc phải một căn bệnh do nấm gây ra cực hiếm gặp. Theo đúng nghĩa đen, nấm mốc đã phát triển trong não của anh này.
Tyson Bottenus, 35 tuổi, là một trong số 120 trường hợp được ghi nhận về bệnh nhiễm trùng Cladophialophora bantiana (một loại nấm kỳ lạ được gọi là “ mốc đen”) kể từ năm 1911 đến nay.
Ở trường hợp của Tyson, loài nấm này đã xâm chiếm não, gây ra hàng loạt triệu chứng nghiêm trọng kể từ khoảng bốn năm trước. Tyson may mắn còn sống, bởi tỷ lệ tử vong ở người nhiễm nấm “mốc đen” là hơn 70%.
Người đàn ông này đang nỗ lực chiến đấu với bệnh tật, đồng thời hy vọng có thể lấy mảng mốc ra khỏi não. Tuy nhiên, đó quả thực là một trận chiến khó khăn khi nền y học hiện đại cũng chưa chắn đạt thành công.
Biến cố của anh Tyson xảy đến cách đây 4 năm. Lúc đó, anh và vị hôn thê của mình, Liza, quyết định tổ chức lễ đính hôn bằng cách cùng nhau đi đạp xe ở Costa Rica. Ngày thứ 3 của kỳ nghỉ, Tyson vô tình bị ngã xe đạp và xây xát khuỷu tay trái. Vết thương không nghiêm trọng nên anh chỉ băng bó vết và để y tá khám vào sáng sớm hôm sau.
Y tá nói với Bottenus rằng những người đi xe đạp đều gặp những vết thương tương tự và điều đó không có gì đáng lo ngại. Quả thực, khuỷu tay của anh ấy nhanh chóng lành lại, và cả hai đã có thể tiếp tục kỳ nghỉ và quay trở lại Mỹ. Nhưng sau khoảng ba tuần, Tyson bắt đầu gặp phải những triệu chứng kỳ lạ. Anh thường xuyên đau đầu dữ dội, liệt mặt và thậm chí khó cười.
Tyson Bottenus đã liên lạc với bác sĩ về những triệu chứng mình gặp phải. Bác sĩ đề nghị anh chụp cộng hưởng từ (MRI) và kết quả cho thấy ở giữa não của anh xuất hiện một vòng tròn kỳ lạ.
Việc xác định vòng tròn kỳ lạ trên cũng không hề đơn giản. Tyson thắc mắc liệu anh có bị bệnh ung thư. Nhưng khi nghe tin về kỳ nghỉ của anh ở Costa Rica, bác sĩ đã xét nghiệm và phát hiện anh mắc bệnh sán lá gan – một căn bệnh do ăn thịt lợn sống. Tiếp đến, anh được xét nghiệm bệnh Lyme, bệnh lao, AIDS và nhiều bệnh ung thư não, nhưng mọi thứ đều cho kết quả âm tính.
Sau hai lần sinh thiết não thất bại, các bác sĩ tại Bệnh viện Đa khoa Massachusetts đã tìm ra nguyên nhân gây ra các vấn đề của Tyson trong khi xét nghiệm một loại ung thư não khác. Họ đã tìm thấy một loại nấm đen trong não của anh. Các xét nghiệm cho thấy đó là nấm Cladophialophora bantiana, hay còn gọi là nấm “mốc đen”.
Loại nấm cực kỳ hiếm gặp này được phát hiện lần đầu tiên vào năm 1911. Và kể từ đó đến nay, chỉ có 120 trường hợp được xác nhận mắc phải “mốc đen”, một nửa trong số đó là ở Ấn Độ. Các bác sĩ không biết chính xác Tyson đã nhiễm bệnh như thế nào, nhưng họ nghi ngờ nó xâm nhập vào cơ thể anh qua vết thương khuỷu tay bị ở Costa Rica.
Người đàn ông 35 tuổi được điều trị bằng thuốc uống chống nấm và steroid để chống sưng tấy và ứ dịch mà nấm gây ra trong não. Thật không may, nó không hiệu quả mạnh như bệnh nhân và các bác sĩ đã hy vọng. Các cuộc thử nghiệm cho thấy thuốc chống nấm đã không đến được não do hàng rào bảo vệ tự nhiên của cơ thể con người. Diễn biến này không quá xấu, vì nó có nghĩa là hệ thống miễn dịch của bệnh nhân ít nhất đã có thể ngăn không cho nấm giết chết mình.
Vào tháng 3/2020, Tyson ngừng dùng thuốc steroid do lo sợ rằng suy yếu hệ miễn dịch và khiến mình nhiễm COVID-19, nhưng anh đã không báo với bác sĩ. Tháng đó, Tyson đã gặp phải một cơn đột quỵ và phải vào viện cấp cứu. Thị lực của anh bị giảm sút nghiêm trọng, chữ viết méo mó, còn giọng nói trở nên ngọng và khàn. Áp lực nội sọ gấp 15 lần bình thường. Một số bác sĩ cho rằng nếu khỏi bệnh, bệnh nhân sẽ bị mù vĩnh viễn.
May mắn thay, cuộc phẫu thuật đã khôi phục lại thị lực của Tyson, song anh vẫn không thể lái ô tô hay chèo thuyền như trước đây. Anh ta tiếp tục chung sống với mảng “mốc đen” trong não, vì vị trí khiến bác sĩ không thể phẫu thuật cắt bỏ cũng như tất cả các loại thuốc thử nghiệm cho đến nay đều thất bại. Tuy nhiên, anh vẫn chưa từ bỏ hy vọng và đang điều trị bằng một loại thuốc chống nấm mới.
“Giọng tôi vẫn ngọng và trí nhớ không tốt. Tôi thường xuyên đi lạc, nhưng vẫn có thể viết báo cáo dài 20 trang”, Tyson Bottenus nói. Sau tất cả những điều đã xảy đến, anh cảm thấy bản thân đã học được cách đương đầu với biến cố bất ngờ trong cuộc sống.
Từ công nghệ "ươm mầm" 6 thập kỷ đến mũi vaccine Covid-19 đầu tiên
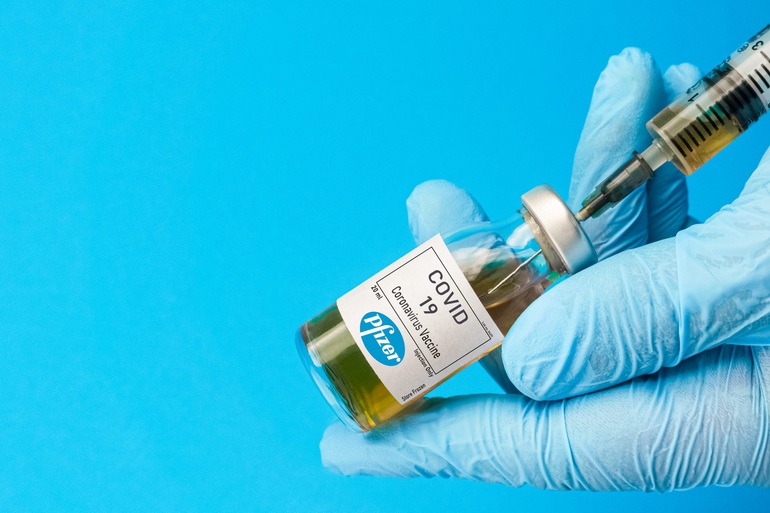
Vaccine Covid-19 của Pfizer - BioNTech mất chưa đến một năm từ khi nghiên cứu đến lúc được cấp phép.
Tuy nhiên, ít ai biết rằng, "trái ngọt" này là thành quả sau hơn 6 thập kỷ thăng trầm.
Vaccine mở đầu cho cuộc phản công Covid-19
Vào ngày 1/1, Tổ chức Y tế thế giới (WHO) thông báo trên Twitter: "Vaccine ngừa Covid-19 của Pfizer - BioNTech đã trở thành vaccine đầu tiên nhận được sự phê duyệt của WHO để sử dụng khẩn cấp kể từ lúc dịch bùng phát".
Sự kiện này đánh dấu một bước ngoặt lớn trong cuộc chiến chống lại đại dịch đang đe dọa toàn cầu, trong bối cảnh loài người vẫn chưa có một thứ "vũ khí" thực sự, để chủ động chống lại kẻ thù đáng gờm với kích thước hiển vi mang tên: SARS-CoV-2.
Vaccine Covid-19 của Pfizer - BioNTech (tên thương mại Comirnaty) gây kinh ngạc với thế giới không chỉ bởi ngôi quán quân trong cuộc đua vaccine, mà còn vì nó được phát triển bằng công nghệ mới nhất trong biên niên sử vaccine: Công nghệ mARN.
Pfizer và BioNTech mất chưa đến một năm để nghiên cứu, sản xuất và được cấp phép vaccine Comirnaty (thời gian nhanh kỷ lục đối với sự ra đời của một loại vaccine, vốn sẽ mất khoảng 5 - 10 năm).
Tuy nhiên, ít ai biết rằng, để thu được "trái ngọt" này, công nghệ mARN đã phải trải qua hàng chục năm "ươm mầm" với nhiều thăng trầm.
Video đang HOT
Vaccine mARN: "trái ngọt" được "ươm mầm" qua 6 thập kỷ
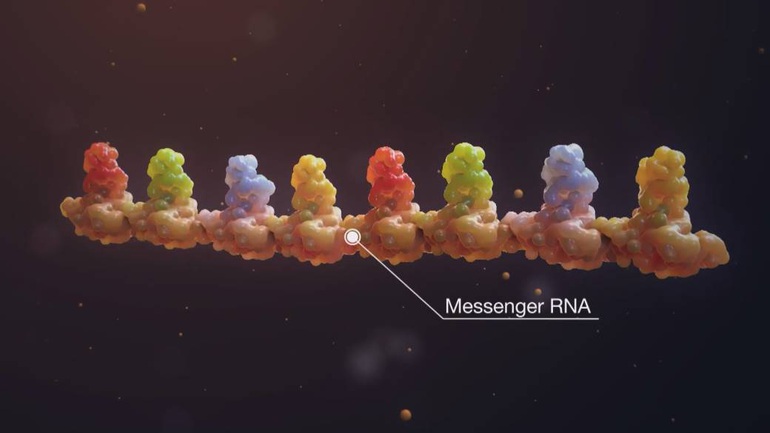
mARN (ARN thông tin) được phát hiện vào năm 1960. Về mặt chức năng, mARN như là một bản sao của các thông tin di truyền gốc ở gen, nghĩa là nó làm nhiệm vụ truyền đạt bản thiết kế protein bậc I do gen quy định.
mARN như là một bản sao của các thông tin di truyền gốc ở gen.
Tuy nhiên, thời điểm đó, mARN dường như bị lu mờ trước cái bóng quá lớn của "người anh" ra đời trước đó vài năm: ADN, một trong những phát hiện vĩ đại nhất của loài người trong thế kỷ 20.
"Thiếu độ tin cậy và thiếu tính ổn định", đó là nhận định của nhiều chuyên gia về mARN vào thời điểm đó. Nhược điểm này cũng trở thành rào cản lớn mà nhiều thế hệ nhà khoa học đã không thể vượt qua để có thể thực sự ứng dụng đoạn mã di truyền này vào cuộc sống.
Cuối năm 1987, nhà khoa học Robert Malone, khi đó là một nghiên cứu sinh tại Viện nghiên cứu sinh học Salk, California (Mỹ) đã thực hiện một thí nghiệm mang tính bước ngoặt.
Ông đã bọc mARN bằng một "lớp áo" chất béo cấu thành từ các hạt liposome. Bằng cách này, mARN có thể thâm nhập dễ dàng vào bên trong các tế bào để có thể chèn thông tin tổng hợp protein.
mARN được bọc bằng một "lớp áo" chất béo cấu thành từ các hạt liposome.
Thí nghiệm này cũng đã phá bỏ "rào cản" đã tồn tại 27 năm, mở đường cho những nghiên cứu sau này về ứng dụng của mARN.
Năm 1984, Paul Krieg, Douglas Melton và cộng sự tại Đại học Harvard đã tạo ra một bước tiến mới cho công nghệ mARN khi trở thành những người đầu tiên tổng hợp được đoạn mã di truyền này.
Nhóm nghiên cứu này đã sử dụng một enzyme tổng hợp mARN của virus và một số công cụ khác để tạo ra những đoạn mARN tổng hợp đầu tiên trên thế giới. Chỉ 3 năm sau, Douglas Melton phát hiện ra rằng, mARN có thể kích hoạt lẫn ngăn chặn sản xuất protein.
Sang giai đoạn những năm 90 của thế kỷ trước, những nỗ lực không ngừng nghỉ trong phòng thí nghiệm của nhà khoa học nữ Katalin Kariko (người Hungary) đã xây những nền móng vững chắc cho việc ứng dụng mARN trong y học. Bà cũng chính là người đóng vai trò quan trọng cho sự ra đời của vaccine Comirnaty sau này.
Nhà khoa học nữ Katalin Kariko (người Hungary) đã xây những nền móng vững chắc cho việc ứng dụng mARN trong y học.
Trong một lần làm thí nghiệm, TS Katalin và cộng sự đã phát hiện ra các protein mới được tạo ra bởi các tế bào. Điều này cho thấy rằng, mARN có thể được sử dụng để chỉ đạo bất kỳ tế bào nào tạo ra bất kỳ loại protein nào theo ý muốn.
"Nếu có thể thiết kế một loại mARN theo mong muốn và đưa vào tế bào, cũng sẽ đồng nghĩa với việc điều khiển được quá trình dịch mã và tạo ra bất kì loại protein nào, điển hình là protein để chữa bệnh", quan điểm này của TS Katalin Kariko đã trở thành "kim chỉ nam" cho nhiều công trình khoa học về sử dụng mARN trong lĩnh vực y sinh.
Nhà khoa học nữ này cũng bắt đầu thử nghiệm dùng mARN trên động vật sống là chuột thay vì trên mẫu nuôi cấy.
Năm 1997, TS Katalin bắt đầu cộng tác với GS Drew Weissmen để cùng nhau phát triển vaccine HIV/AIDS. Tuy nhiên họ cũng đã nếm trải nhiều thất bại khi mARN gây ra phản ứng viêm quá mức trên chuột.
Nguyên nhân nhanh chóng được tìm ra: mARN đã kích ứng một loạt các thụ thể miễn dịch dạng Toll (đáp ứng đầu tiên đối với các tín hiệu nguy hiểm từ mầm bệnh).
Tuy nhiên, để giải bài toán "làm sao cho mARN tổng hợp không bị hệ miễn dịch nhận biết", hai nhà khoa học đã dành gần một thập kỷ "vùi đầu" trong phòng thí nghiệm.
Sau nhiều lần đứng lên từ những thất bại, "quả ngọt" cuối cùng đã đến với TS Katalin và GS Weissmen vào năm 2005. Họ đã thay nucleotide uridine bởi một chất tương tự là pseudouridine để ngăn hệ miễn dịch của cơ thể xác định mARN ngoại lai là kẻ thù. Ngay sau đó, bộ đôi này đã xuất bản một bài báo, nộp bằng sáng chế và thành lập công ty công nghệ sinh học để thương mại hóa sản phẩm của mình.
Công bố của TS Katalin và GS Weissmen được xem là một bước tiến lớn trong việc phát triển các loại thuốc/vaccine dựa trên mARN. Tuy nhiên lúc bấy giờ, rất ít nhà khoa học công nhận giá trị y khoa của chuỗi mARN sửa đổi này.
Giá trị của nghiên cứu này chỉ được đánh giá đúng khi nó thu hút được sự chú ý của GS Derrick Rossi của Trường Y Harvard (Mỹ). GS Rossi còn tin tưởng rằng, đây là một công trình xứng đáng với một giải Nobel.
Đến tháng 9/2010, nhóm nghiên cứu tế bào gốc của GS Derrick Rossi tại Bệnh viện Nhi Boston đã mô tả cách sử dụng mARN sửa đổi để biến đổi tế bào da thành tế bào gốc dạng phôi rồi thành mô cơ. Rossi được tạp chí Time tôn vinh là một trong những nhân vật quan trọng nhất năm 2010.
Điều thú vị là GS Derrick Rossi, sau này cũng chính là nhà đồng sáng lập của một cái tên nổi tiếng không kém Pfizer - BioNTech về vaccine Covid-19 mARN ở thời điểm hiện tại: Moderna.
Không chỉ có GS Derrick Rossi, một công ty chuyên về công nghệ y sinh non trẻ tại Mainz, Đức cũng đã nhanh chóng nhận ra được tiềm năng to lớn của công nghệ mARN. Cái tên của công ty này có lẽ cũng không hề xa lạ ở thời điểm hiện tại: BioNTech.
Ugur Sahin và vợ là zlem Treci là 2 nhà sáng lập BioNTech.
Công ty này được thành lập bởi 2 nhà nghiên cứu có niềm đam mê với liệu pháp miễn dịch: Ugur Sahin và vợ là zlem Treci. Khác với GS Derrick Rossi (vốn ứng dụng mARN vào công nghệ tế bào gốc), những nhà sáng lập của BioNTech ngay từ đầu đã nhận định rằng: "Công nghệ mARN sẽ là cuộc cách mạng trong sản xuất vaccine".
Trong cuộc gặp gỡ được xem là "định mệnh" vào năm 2013, TS Katalin nhận lời Ugur Sahin về làm Phó Chủ tịch cấp cao tại BioNTech và mở ra một trang mới cho "Startup" về y sinh này.
Cái bắt tay của "gã khổng lồ" và "người tí hon"
"Nhiều người dân ở Vũ Hán, một thành phố với 11 triệu dân tại miền Trung, Trung Quốc, được chẩn đoán mắc một chứng "viêm phổi lạ"", một báo cáo được đăng tải lúc nửa đêm ngày 30/12/2019 của Hiệp hội quốc tế về các bệnh truyền nhiễm.
Bản báo cáo này cũng chính là "tiếng chuông" điểm thời khắc thay đổi cả thế giới.
Khu chợ hải sản ở Vũ Hán đóng cửa sau khi phát hiện các ca mắc chứng "viêm phổi lạ" đầu tiên.
Ở Đức, Sahin, nhà lãnh đạo của BioNTech đã sớm nhận ra nguy cơ về một đại dịch toàn cầu từ những báo cáo bước đầu về bệnh "viêm phổi lạ" này.
"Chúng ta phải chống lại đại dịch này", Sahin nói với các thành viên chủ chốt của BioNTech trong cuộc họp được tổ chức ngay sáng hôm sau.
Sau khi phân lập được mẫu virus từ bệnh nhân, các nhà khoa học Trung Quốc đã công bố trình tự gen được giải mã của virus SARS-CoV-2. Với công nghệ mARN, đó là tất cả những gì cần có để có thể bắt đầu sản xuất vaccine.
"Khi người Trung Quốc công bố trình tự của SARS-CoV-2, chúng tôi bắt đầu quá trình tạo mARN vào hôm sau. Vài tuần sau, chúng tôi tiêm vaccine cho động vật", một chuyên gia của BioNTech chia sẻ.
Nơi nghiên cứu, sản xuất vaccine của Pfizer - BioNTech.
Nhà lãnh đạo của BioNTech cũng nhận ra rằng, mình cần một đối tác có tiềm lực lớn về sản xuất vaccine. "Pfizer" là cái tên ngay lập tức xuất hiện trong đầu ông. Trên thực tế, trước đó cả 2 công ty đã từng hợp tác để phát triển vaccine cúm bằng công nghệ mARN.
Vào tháng 3/2020, Sahin gọi điện cho chuyên gia hàng đầu về vaccine của Pfizer là Kathrin Jansen để trao đổi về việc hợp tác.
"Tôi đã hỏi qua điện thoại rằng, Pfizer có muốn hợp tác với chúng tôi không. "Có, chúng tôi rất muốn làm điều đó", bà ấy trả lời không một chút do dự", Sahin nhớ lại.
Cuộc gọi này cũng đã mở đầu cho sự hợp tác đặc biệt giữa Pfizer: Gã khổng lồ ngành dược có 171 năm lịch sử với 500 cơ sở và BioNTech: Công ty non trẻ, không mấy tiếng tăm nhưng lại sở hữu chiếc chìa khóa vàng mang tên "Công nghệ mARN".
Pfizer và BioNTech bắt đầu nghiên cứu trên người vào cuối tháng 4, chậm hơn một tháng so với Moderna.
4 loại vaccine do Pfizer - BioNTech nghiên cứu dần mang lại kết quả trong mùa hè. Đến cuối tháng 7, họ đã chọn được ứng viên mARN nhắm mục tiêu một protein đột biến toàn phần, giống mục tiêu của Moderna, và bắt đầu thử nghiệm lâm sàng giai đoạn cuối với 30.000 người.
Ngày 15/11, ủy viên ban quản trị Pfizer là Mikael Dolsten cùng các đồng nghiệp đã chứng kiến khoảnh khắc lớn nhất trong sự nghiệp của mình tại một phòng thí nghiệm ở bang Connecticut: Thời khắc kết quả nghiên cứu lâm sàng giai đoạn cuối của "đứa con tinh thần" được đưa ra.
Dữ liệu sơ bộ cho thấy hiệu quả của vaccine đạt 90%, kết quả cuối cùng được công bố vài ngày sau khi hoàn tất thử nghiệm giai đoạn ba lên đến 95%. Trong khi đó, nhiều chuyên gia virus hy vọng vaccine chỉ cần đạt được hiệu quả 70-80% đã ngăn được Covid-19.
Vào tháng 12 năm 2020, Anh Quốc là nước đầu tiên cấp phép sử dụng khẩn cấp vaccine Comirnaty, kế đó là Hoa Kỳ, Liên minh châu Âu và WHO...
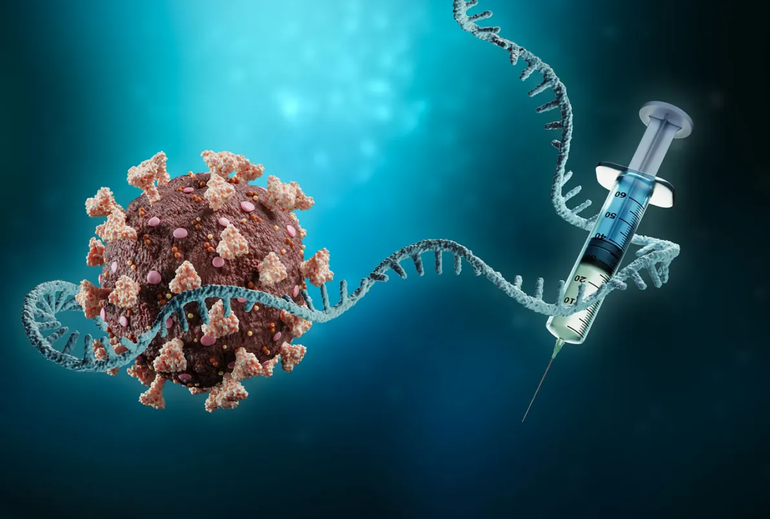
Đến nay, loại vaccine được phát triển thần tốc này đã trở thành một nhân tố quan trọng trong cuộc chiến với đại dịch, đặc biệt là trong chiến lược thích ứng với Covid-19. Hàng trăm triệu người dân trên toàn cầu được trang bị "lá chắn miễn dịch" trước SARS-CoV-2, nhờ loại vaccine được phát triển bởi công nghệ mang tính "cách mạng" này.
Không dùng đến virus, vaccine mARN tạo miễn dịch như thế nào?
Theo CDC Hoa kỳ, để kích hoạt phản ứng miễn dịch của cơ thể giúp chống lại các bệnh truyền nhiễm, cách cổ điển của nhiều loại vaccine trước đây là đưa một lượng virus hoặc vi khuẩn đã bị bất hoạt hoặc làm suy yếu vào cơ thể con người.
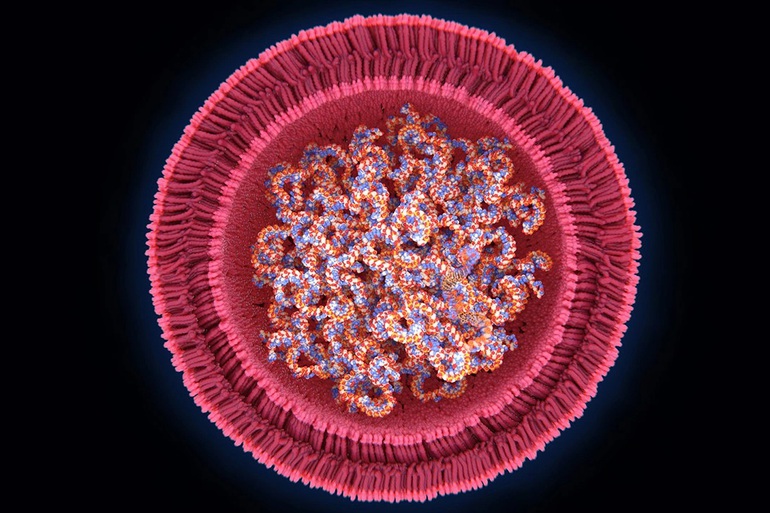
Trong khi đó, vaccine Covid-19 được sản xuất bằng công nghệ mARN sẽ cung cấp các hướng dẫn cho tế bào của cơ thể con người tạo ra các "mảnh" vô hại, được gọi là "protein đột biến". Loại protein đột biến này được tìm thấy trên bề mặt của virus SARS-CoV-2.
Cụ thể hơn, khi vaccine mARN được tiêm vào cơ thể, các mARN sẽ đi vào và nằm bên trong các tế bào miễn dịch, kích thích các tế bào tạo ra các mảnh protein. Sau khi mảnh protein được tạo ra, tế bào sẽ phá vỡ các mARN và loại bỏ chúng.
Tiếp theo, các tế bào sẽ hiển thị các mảnh protein lên trên bề mặt, hệ thống miễn dịch của cơ thể sẽ nhận ra rằng các mảnh protein không thuộc về cơ thể và bắt đầu tạo ra các phản ứng miễn dịch, từ đó sinh kháng thể chống lại các mảnh protein này, điều này giống như những gì xảy ra khi nhiễm SARS-CoV-2 tự nhiên.
Sau một thời gian, cơ thể sẽ học được cách bảo vệ chống lại sự lây nhiễm SARS-CoV-2 trong tương lai. Như vậy, vaccine mARN mang lại lợi ích giống như tất cả các loại vaccine khác, là giúp cơ thể chống lại sự tấn công của virus gây bệnh Covid-19.
Công nghệ mARN: Không chỉ là vaccine Covid-19
Nền tảng công nghệ mARN chính là chìa khóa để tạo ra các loại vaccine an toàn và hiệu quả đáng kể để chống lại các loại virus mới trong tương lai.
Cùng với đó, công nghệ này cũng đang cho thấy nhiều hứa hẹn chống lại những "kẻ thù" cũ như HIV và các bệnh nhiễm trùng đe dọa trẻ sơ sinh và trẻ nhỏ, chẳng hạn như virus hợp bào hô hấp (RSV).
Ngoài ra, công nghệ vaccine mARN trong tương lai có thể cho phép tạo ra một loại vaccine "đa năng", có thể bảo vệ con người trước nhiều bệnh. Từ đó sẽ làm giảm số lượng mũi tiêm cần thiết để bảo vệ cơ thể khỏi các bệnh lây nhiễm phổ biến có thể phòng ngừa bằng vaccine.
Bên cạnh đó, hiện nay các nhà khoa học còn nghiên cứu sử dụng mARN để kích hoạt hệ thống miễn dịch nhằm vào các tế bào ung thư cụ thể.
Sử dụng mARN để chống lại các bệnh tự miễn cũng là một hướng đi đang nhận được nhiều sự quan tâm.
BioNTech đã làm việc với các nhà nghiên cứu để sử dụng mARN điều trị cho chuột được biến đổi gen, nhằm chữa trị một căn bệnh tương tự như bệnh đa xơ cứng. Đây là một bệnh tự miễn xuất hiện khi hệ thống miễn dịch tấn công nhầm vào myelin - một chất béo bao phủ các tế bào thần kinh.
Ở chuột, phương pháp điều trị dường như giúp ngăn chặn "cuộc tấn công", trong khi giữ nguyên phần còn lại của hệ thống miễn dịch.
Tối 20/1, Giải thưởng VinFuture đã diễn ra tại Nhà hát Lớn ở Hà Nội với sự tham dự của đông đảo các đại biểu trong nước và quốc tế. Giải thưởng Chính - giải thưởng cao nhất, với phần thưởng trị giá 3 triệu USD - đã vinh danh 3 nhà khoa học Katalin Kariko, Drew Weissman và Pieter R. Cullis với các công trình nghiên cứu giúp tạo nên vaccine Covid-19 sử dụng công nghệ mRNA - góp phần cứu sống hàng tỷ người trên thế giới khỏi đại dịch toàn cầu.
Chế độ ăn giàu kẽm giúp phòng tránh ung thư đường tiêu hóa  Các nghiên cứu cho thấy, một số vitamin và chất khoáng cũng như các chất chống oxy hóa trong thực phẩm có vai trò phòng chống ung thư, làm chậm quá trình lão hóa ở người. Theo Viện Dinh dưỡng Quốc gia, ung thư các bộ phận của đường tiêu hóa như: vòm miệng, thực quản, dạ dày, đại tràng... được chứng minh...
Các nghiên cứu cho thấy, một số vitamin và chất khoáng cũng như các chất chống oxy hóa trong thực phẩm có vai trò phòng chống ung thư, làm chậm quá trình lão hóa ở người. Theo Viện Dinh dưỡng Quốc gia, ung thư các bộ phận của đường tiêu hóa như: vòm miệng, thực quản, dạ dày, đại tràng... được chứng minh...
 Thông tin mới nhất vụ cô gái bị bắt cóc đòi chuộc 150 triệu đồng02:01
Thông tin mới nhất vụ cô gái bị bắt cóc đòi chuộc 150 triệu đồng02:01 Trung Quốc tung chatbot đấu ChatGPT, cổ phiếu Phố Wall chao đảo bốc hơi 1.000 tỉ14:53
Trung Quốc tung chatbot đấu ChatGPT, cổ phiếu Phố Wall chao đảo bốc hơi 1.000 tỉ14:53 Quán bún Hà Nội xin lỗi vụ bán 1,2 triệu đồng 3 bát bún riêu ngày Tết, nói chỉ là 'hiểu lầm'09:39
Quán bún Hà Nội xin lỗi vụ bán 1,2 triệu đồng 3 bát bún riêu ngày Tết, nói chỉ là 'hiểu lầm'09:39 Đường dây lừa đảo 13.000 người: Biệt danh ACE của 3 quản lý cấp cao02:36
Đường dây lừa đảo 13.000 người: Biệt danh ACE của 3 quản lý cấp cao02:36 Vụ xe ôtô lao xuống mương 7 người tử vong: Công an công bố nguyên nhân ban đầu14:39
Vụ xe ôtô lao xuống mương 7 người tử vong: Công an công bố nguyên nhân ban đầu14:39 11 'quái xế' chạy vào cao tốc Nghi Sơn - Diễn Châu bị phạt 78 triệu đồng501:27
11 'quái xế' chạy vào cao tốc Nghi Sơn - Diễn Châu bị phạt 78 triệu đồng501:27 Hé lộ kế hoạch mới của ông Trump về xung đột Nga-Ukraine08:31
Hé lộ kế hoạch mới của ông Trump về xung đột Nga-Ukraine08:31 Tổng thống Trump lên tiếng về 'thảm kịch' hàng không ở thủ đô Washington DC10:41
Tổng thống Trump lên tiếng về 'thảm kịch' hàng không ở thủ đô Washington DC10:41 'Chiến thắng' đầu tiên của Tổng thống Trump trong cuộc chiến trục xuất di dân lậu09:26
'Chiến thắng' đầu tiên của Tổng thống Trump trong cuộc chiến trục xuất di dân lậu09:26 Lãnh đạo nước ngoài đầu tiên được ông Trump mời đến Nhà Trắng08:45
Lãnh đạo nước ngoài đầu tiên được ông Trump mời đến Nhà Trắng08:45 Hàn Quốc sắp nhận trực thăng mới từ Mỹ để đối phó tàu ngầm Triều Tiên09:58
Hàn Quốc sắp nhận trực thăng mới từ Mỹ để đối phó tàu ngầm Triều Tiên09:58Tiêu điểm
Tin đang nóng
Tin mới nhất

Ăn thì là có tác dụng gì?

Ăn hạt dẻ thường xuyên: 5 lợi ích 'vàng' cho sức khỏe
Cách cải thiện sức khỏe đường ruột
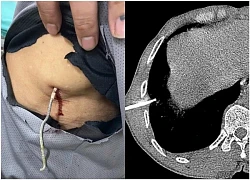
Người đàn ông bị dây kẽm dài 20cm xuyên vào lồng ngực

Dấu hiệu và cách xử trí ngộ độc rượu

Ăn uống đúng cách giúp phòng ngừa rối loạn tiêu hóa dịp Tết

Vì sao không nên uống thuốc với trà?

Những loại hạt nào được dùng trong ngày tết có dinh dưỡng cao?
8 ngày nghỉ Tết, hơn 24.000 người cấp cứu liên quan đến tai nạn giao thông

Chế độ dinh dưỡng, tập luyện hợp lý cho phụ nữ giảm cân dịp Tết

7 bài tập giảm đầy bụng, khó tiêu

6 đồ uống giúp hơi thở thơm tho, giảm hôi miệng ngày Tết
Có thể bạn quan tâm

Mẹo kẻ chân mày nhanh và đẹp
Làm đẹp
15:52:02 03/02/2025
Team qua đường "tóm dính" cặp chị - em Vbiz ở sân bay, đưa nhau về ra mắt gia đình hậu hẹn hò bí mật?
Sao việt
15:43:43 03/02/2025
Từ Hy Viên trước khi mất: Tài hoa bạc mệnh, cuộc hôn nhân nhiều nước mắt
Sao châu á
15:33:25 03/02/2025
Độc nhất vô nhị tại Grammy 2025: Taylor Swift 1 mình làm hành động lạ giữa lễ trao giải, biết lý do càng bất ngờ hơn
Sao âu mỹ
15:29:45 03/02/2025
Chủ tịch CLB Hà Nội cầm xấp tiền lì xì cầu thủ, phong thái khác hẳn lúc ở nhà với hoa hậu Đỗ Mỹ Linh
Netizen
15:28:47 03/02/2025
Bộ phim đỉnh nhất của Từ Hy Viên: Nữ thần một thời, nhan sắc không đối thủ
Hậu trường phim
15:15:03 03/02/2025
Bộ phim cuối cùng của Từ Hy Viên trước khi qua đời
Phim châu á
15:12:18 03/02/2025
9 ngày nghỉ Tết, CSGT TPHCM xử lý hơn 4.800 trường hợp vi phạm
Tin nổi bật
14:24:13 03/02/2025
Lộ khoảnh khắc Quang Hải lì xì cho họ hàng, dân mạng tranh cãi cực gắt vì "người nổi tiếng mà lì xì 200k"?
Sao thể thao
13:02:20 03/02/2025
Mặc đầm lụa satin để khoe sắc ngày xuân
Thời trang
12:50:48 03/02/2025
 Uống thuốc chữa Covid-19 trên mạng, F0 chảy máu tiêu hoá
Uống thuốc chữa Covid-19 trên mạng, F0 chảy máu tiêu hoá Covid-19: Chuyên gia cảnh báo về thuốc kháng virus “xách tay Nga”
Covid-19: Chuyên gia cảnh báo về thuốc kháng virus “xách tay Nga”






 Cặp vợ chồng 9x liên tiếp mắc ung thư không rõ lý do, bác sĩ nói: Tiếc là đã duy trì ăn loại trái cây này quá nhiều
Cặp vợ chồng 9x liên tiếp mắc ung thư không rõ lý do, bác sĩ nói: Tiếc là đã duy trì ăn loại trái cây này quá nhiều Loại gạo có khả năng gây ung thư cao bậc nhất, WHO đã cảnh báo từ lâu nhưng nhiều gia đình vẫn cố tiêu thụ
Loại gạo có khả năng gây ung thư cao bậc nhất, WHO đã cảnh báo từ lâu nhưng nhiều gia đình vẫn cố tiêu thụ 6 loại đồ ăn ai cũng thèm khi đói bụng nhưng lại chính là "hung thủ" gây bệnh, kích thích tế bào ung thư phát triển thần tốc
6 loại đồ ăn ai cũng thèm khi đói bụng nhưng lại chính là "hung thủ" gây bệnh, kích thích tế bào ung thư phát triển thần tốc Lỡ ăn phải bánh mì mốc có sao không?
Lỡ ăn phải bánh mì mốc có sao không? Cặp vợ chồng 47 tuổi mắc ung thư gan không rõ lý do, bác sĩ nói "thủ phạm" đã ở trong mâm cơm nhiều năm mà không biết
Cặp vợ chồng 47 tuổi mắc ung thư gan không rõ lý do, bác sĩ nói "thủ phạm" đã ở trong mâm cơm nhiều năm mà không biết Sau "nấm đen", Ấn Độ báo động nguy cơ nhiễm "nấm trắng" ở bệnh nhân COVID-19
Sau "nấm đen", Ấn Độ báo động nguy cơ nhiễm "nấm trắng" ở bệnh nhân COVID-19 Uống cà phê thường xuyên có hại hay lợi cho gan?
Uống cà phê thường xuyên có hại hay lợi cho gan? Rối loạn mỡ máu ở người cao tuổi nên ăn gì?
Rối loạn mỡ máu ở người cao tuổi nên ăn gì? Hai chị em nguy kịch sau khi uống lọ dung dịch màu hồng vứt ngoài ruộng
Hai chị em nguy kịch sau khi uống lọ dung dịch màu hồng vứt ngoài ruộng '3 nhiều, 1 giảm' cảnh báo bệnh tiểu đường
'3 nhiều, 1 giảm' cảnh báo bệnh tiểu đường Phát hiện mới cải thiện hiệu quả điều trị cho bệnh nhân ung thư vú
Phát hiện mới cải thiện hiệu quả điều trị cho bệnh nhân ung thư vú Các bước đơn giản nhất để bắt đầu thiền định
Các bước đơn giản nhất để bắt đầu thiền định Loại quả 'báu vật' ngày Tết, cực tốt cho sức khỏe nhiều người lại chỉ để ngắm
Loại quả 'báu vật' ngày Tết, cực tốt cho sức khỏe nhiều người lại chỉ để ngắm Ba không khi ăn hạt bí
Ba không khi ăn hạt bí Chấn động: Từ Hy Viên qua đời
Chấn động: Từ Hy Viên qua đời Chồng cũ Uông Tiểu Phi bị chỉ trích vì động thái ngay khi Từ Hy Viên qua đời
Chồng cũ Uông Tiểu Phi bị chỉ trích vì động thái ngay khi Từ Hy Viên qua đời Tạm giữ nhóm đối tượng giết trộm 6 con trâu của người dân trong dịp Tết
Tạm giữ nhóm đối tượng giết trộm 6 con trâu của người dân trong dịp Tết Xót xa khoảnh khắc lộ diện cuối đời của Từ Hy Viên
Xót xa khoảnh khắc lộ diện cuối đời của Từ Hy Viên Thi hài Từ Hy Viên được hỏa táng ở Nhật, di ngôn hé lộ tâm nguyện sau lần thập tử nhất sinh 9 năm trước
Thi hài Từ Hy Viên được hỏa táng ở Nhật, di ngôn hé lộ tâm nguyện sau lần thập tử nhất sinh 9 năm trước Ca sĩ Minh Tuyết: "Hơn 20 năm, chồng chưa từng khiến tôi phải nghi ngờ"
Ca sĩ Minh Tuyết: "Hơn 20 năm, chồng chưa từng khiến tôi phải nghi ngờ" Từ Hy Viên qua đời, chồng cũ doanh nhân vội về nước tranh gia sản
Từ Hy Viên qua đời, chồng cũ doanh nhân vội về nước tranh gia sản Đạo diễn Nguyễn Ngọc Quyền đột ngột qua đời ở tuổi 36, đồng nghiệp tiết lộ nguyên nhân
Đạo diễn Nguyễn Ngọc Quyền đột ngột qua đời ở tuổi 36, đồng nghiệp tiết lộ nguyên nhân Thêm 1 sao nam lên tiếng về drama chê phim Trấn Thành, đứng ra giảng hoà nhưng bị Lê Giang đáp trả đến câm nín
Thêm 1 sao nam lên tiếng về drama chê phim Trấn Thành, đứng ra giảng hoà nhưng bị Lê Giang đáp trả đến câm nín
 Hoa hậu hạng A Vbiz công bố 7 bức ảnh chưa từng thấy sau khi quay lại với bạn trai cũ
Hoa hậu hạng A Vbiz công bố 7 bức ảnh chưa từng thấy sau khi quay lại với bạn trai cũ Chấn động vụ đánh ghen ngay tại rạp Việt dịp Tết, tình tiết y hệt phim Trấn Thành khiến 3,6 triệu người quá sốc
Chấn động vụ đánh ghen ngay tại rạp Việt dịp Tết, tình tiết y hệt phim Trấn Thành khiến 3,6 triệu người quá sốc Vụ tai nạn 7 người tử vong ở Nam Định: Nữ tài xế đột ngột đánh lái sang phải
Vụ tai nạn 7 người tử vong ở Nam Định: Nữ tài xế đột ngột đánh lái sang phải Mỹ nam Việt đẹp tới mức không một ai chê nổi: Nhìn tưởng siêu sao xứ Hàn lại hao hao Hứa Quang Hán mới tài
Mỹ nam Việt đẹp tới mức không một ai chê nổi: Nhìn tưởng siêu sao xứ Hàn lại hao hao Hứa Quang Hán mới tài
 Tình trạng đáng lo của Khả Ngân ngày đầu năm mới
Tình trạng đáng lo của Khả Ngân ngày đầu năm mới