Hai bước cuối để cấp phép khẩn cấp vaccine Covid-19 Nanocovax
Nanocovax còn cần được Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc thẩm định hồ sơ, đánh giá hiệu quả bảo vệ, trước khi đề xuất Bộ Y tế cấp phép khẩn cấp.
Hướng dẫn đăng ký lưu hành vaccine Covid-19 trong trường hợp khẩn cấp của Bộ Y tế ngày 19/8 nêu rõ, vaccine sản xuất trong nước cần có kết quả đánh giá giữa kỳ thử nghiệm lâm sàng giai đoạn ba về tính an toàn, hiệu quả bảo vệ dựa trên dữ liệu của tính sinh miễn dịch đã có. Hồ sơ xin cấp phép cần có ý kiến của Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia (gọi tắt là Hội đồng Đạo đức) và Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (gọi tắt là Hội đồng Tư vấn), trước khi đề xuất Bộ Y tế cấp phép khẩn cấp.
Cụ thể trường hợp của Nanocovax, các yêu cầu về mặt hồ sơ theo hướng dẫn từ Bộ Y tế đã được nhà sản xuất đáp ứng. Hiện vaccine đã có đánh giá từ nhóm nghiên cứu về tính an toàn, tính sinh miễn dịch, hiệu lực bảo vệ trong báo cáo giữa kỳ thử nghiệm lâm sàng giai đoạn ba. Hôm 6/8, nhà sản xuất ước lượng hiệu quả bảo vệ của vaccine khoảng 90% dựa trên kết quả nghiên cứu lâm sàng giai đoạn hai của Viện Pasteur TP HCM, so sánh kết quả sinh miễn dịch trên nhóm người tiêm Nanocovax và nhóm đã khỏi Covid-19.
Do đó, ngày 18/9, Hội đồng đạo đức đã họp thẩm định về báo cáo giữa kỳ giai đoạn ba. Hội đồng đánh giá vaccine an toàn, sinh miễn dịch song chưa có dữ liệu đánh giá trực tiếp hiệu lực bảo vệ và đồng ý sử dụng các kết quả này để tiếp tục họp xem xét cấp phép. Bên cạnh đó, Hội đồng Đạo đức yêu cầu nhóm nghiên cứu tiếp tục đánh giá hiệu quả bảo vệ theo đề cương đã phê duyệt, cập nhật kịp thời kết quả nghiên cứu, uớc tính hiệu quả bảo vệ của Nanocovax dựa trên dữ liệu về tính sinh miễn dịch đảm bảo khoa học để chuyển hồ sơ cho Hội đồng Tư vấn thẩm định.
Như vậy, vaccine Nanocovax còn hai bước xét duyệt nữa trước cánh cửa cấp phép khẩn cấp . Nếu không thông qua, Hội đồng Tư vấn sẽ yêu cầu nhà sản xuất tiếp tục bổ sung hồ sơ vaccine. Nếu được thông qua, Hội đồng Tư vấn sẽ đề xuất Bộ Y tế cấp phép khẩn cấp cho Nanocovax. Sau đó, vaccine chỉ được sử dụng có điều kiện theo số lượng và kế hoạch được Bộ Y tế phê duyệt. Những người tiêm Nanocovax sẽ được theo dõi chặt chẽ về tính an toàn tương tự nhóm tham gia nghiên cứu giai đoạn 3b, theo kết luận của Hội đồng Đạo đức ngày 28/8.
Video đang HOT
Đại diện Hội đồng Tư vấn cấp phép ngày 20/9 cho biết chưa nhận được biên bản nghiệm thu về vaccine Nanocovax của Hội đồng Đạo đức và các hồ sơ cập nhật khác. Ông cũng cho biết các chuyên gia của hội đồng sẽ làm việc gấp rút và tổ chức họp trong thời gian sớm nhất khi nhận được dữ liệu.
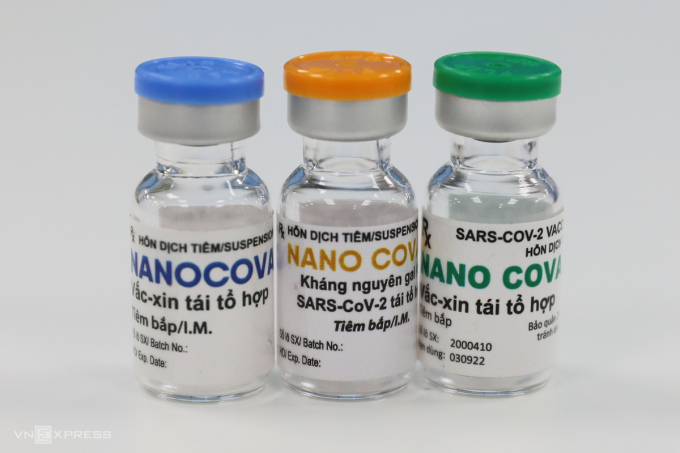
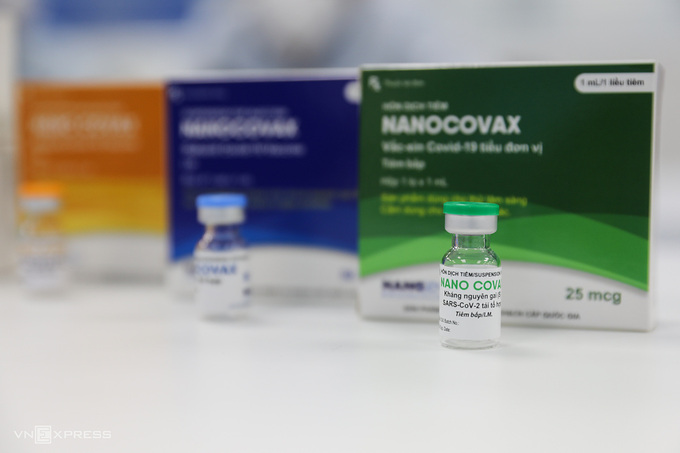
Nanocovax là vaccine Covid-19 do Công ty Nanogen nghiên cứu, phát triển. Vaccine được sản xuất dựa trên công nghệ tái tổ hợp, tức sử dụng những mảnh kháng nguyên vô hại (protein) thích hợp nhất của nCoV để kích thích tạo đáp ứng miễn dịch. Một liệu trình vaccine có hai liều tiêm cách nhau 28 ngày.
Hiện, Nanogen phối hợp với Học viện Quân y và Viện Pasteur TP HCM thử nghiệm giai đoạn ba vaccine, gồm 2 pha là 3a trên 1.000 người và 3b trên 12.000, mức liều thử nghiệm là 25 mcg. Nhóm nghiên cứu đã hoàn thành hai liều tiêm cho 13.000 người thử nghiệm giai đoạn ba, bước vào quá trình theo dõi, đánh giá vaccine và báo cáo cho Bộ Y tế.
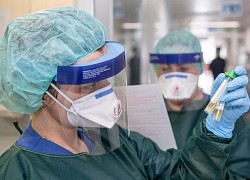
Vaccine Covid-19 Nanocovax do công ty Nanogen nghiên cứu và sản xuất. Ảnh: Quỳnh Trần
Hội đồng đạo đức thông qua kết quả giữa kỳ 3a vaccine Nanocovax
Kết quả thử nghiệm giữa kỳ giai đoạn 3a vaccine Covid-19 Nanocovax đã được Hội đồng đạo đức trong nghiên cứu y sinh học Quốc gia chấp thuận, chờ họp cấp phép.
Một thành viên (không muốn nêu tên) nhóm nghiên cứu vaccine Nanocovax cho VnExpress biết tin này chiều 27/8.
Theo quy trình, sau khi được Hội đồng đạo đức trong nghiên cứu y sinh học Quốc gia (gọi tắt là Hội đồng đạo đức) thông qua, hồ sơ của vaccine Nanocovax được chuyển sang Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, Bộ Y tế để tiếp tục xem xét cấp phép khẩn cấp cho vaccine Nanocovax.
Đại diện Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, cũng cho biết các chuyên gia đang nghiên cứu hồ sơ, chưa có lịch họp xem xét việc cấp phép vaccine Nanocovax.
Nanocovax là vaccine Covid-19 do Công ty Nanogen nghiên cứu, phát triển, hiện là ứng viên vaccine triển vọng nhất trong nước. Hôm 22/8, Hội đồng đạo đức đã họp, thẩm định báo cáo giữa kỳ pha 3a vaccine này, đánh giá về tính an toàn và tính sinh miễn dịch.
Hồi đầu tháng 8, Nanogen gửi công văn tới Bộ Y tế, cập nhật kết quả nghiên cứu Nanocovax ở giai đoạn nghiên cứu lâm sàng một và hai. Trong đó, Nanogen ước lượng hiệu quả bảo vệ của Nanocovax là 90%, hàm lượng kháng thể do vaccine sinh ra cao hơn nhóm người đã khỏi Covid-19. Các kết quả này dựa trên nghiên cứu giai đoạn hai của Viện Pasteur TP HCM, đơn vị phối hợp với Học viện Quân y triển khai thử nghiệm lâm sàng trên toàn quốc. Vì vậy, công ty kết luận "vaccine có hiệu quả tốt phòng Covid-19".
Trước đó, hôm 22/7, đại diện Bộ Y tế cho biết hồ sơ kết quả nghiên cứu lâm sàng giai đoạn một và hai, kết quả giữa kỳ giai đoạn 3a "là căn cứ để xem xét đề xuất cấp phép khẩn cấp đối với Nanocovax". Các dữ liệu này phải chứng minh được vaccine an toàn, hiệu quả; hồ sơ chặt chẽ, khoa học...
Vaccine có ba giai đoạn thử nghiệm lâm sàng. Giai đoạn một và hai nhằm đánh giá một phần tính an toàn, tính sinh miễn dịch của vaccine. Hội đồng đạo đức đã nghiệm thu, thông qua kết quả nghiên cứu hai giai đoạn này hôm 7/8, đánh giá Nanocovax an toàn, sinh miễn dịch.
Giai đoạn ba bắt đầu từ 11/6, trên 13.000 người, đánh giá tính an toàn, sinh miễn dịch và hiệu quả bảo vệ của vaccine. Trong đó, giai đoạn 3 chia thành hai giai đoạn gồm 3a thử nghiệm trên 1.004 người tình nguyện ở Hà Nội và Long An, theo tỷ lệ cứ 6 người tiêm vaccine thì có một người tiêm giả dược; 3b thử nghiệm trên 12.000 người, tỷ lệ hai người tiêm vaccine, một người tiêm giả dược, tại Hà Nội, Hưng Yên, Long An, Tiền Giang.
Thử nghiệm được làm mù, tức nghiên cứu viên và người tình nguyện không biết ai được tiêm vaccine, ai được tiêm giả dược. Tỷ lệ các nhóm tuổi tham gia nghiên cứu lâm sàng giai đoạn 3a là 60% người từ 18-45 tuổi, 22% từ 46-60 tuổi, hơn 17% còn lại là nhóm trên 60 tuổi.
Vaccine Nanocovax tại nhà máy của Công ty Nanogen tại TP HCM. Ảnh: Quỳnh Trần
Vaccine Nanocovax thỏa mãn hai điều kiện: An toàn và hiệu quả  Hội đồng Đạo đức trong nghiên cứu y sinh học quốc gia sẽ họp thẩm định kết quả bổ sung hồ sơ về thử nghiệm lâm sàng và đăng ký vaccine Nanocovax trong thời gian tới. Nhân dịp này, Thiếu tướng, PGS, TS Nguyễn Viết Lượng, Chính ủy Học viện Quân y đã chia sẻ với Báo Quân đội nhân dân Điện tử...
Hội đồng Đạo đức trong nghiên cứu y sinh học quốc gia sẽ họp thẩm định kết quả bổ sung hồ sơ về thử nghiệm lâm sàng và đăng ký vaccine Nanocovax trong thời gian tới. Nhân dịp này, Thiếu tướng, PGS, TS Nguyễn Viết Lượng, Chính ủy Học viện Quân y đã chia sẻ với Báo Quân đội nhân dân Điện tử...
 Vụ dụ dỗ người dân tu tập mê tín: Một bị hại phải bán 3 căn nhà ở Hà Nội01:02
Vụ dụ dỗ người dân tu tập mê tín: Một bị hại phải bán 3 căn nhà ở Hà Nội01:02 Xe Camry quay đầu giữa giao lộ thì "chạm trán" Lexus giá gần chục tỷ đồng00:36
Xe Camry quay đầu giữa giao lộ thì "chạm trán" Lexus giá gần chục tỷ đồng00:36 Công an xác minh clip người đàn ông khuyết tật bị hai thanh niên đi xe máy không mũ bảo hiểm tát vào đầu01:20
Công an xác minh clip người đàn ông khuyết tật bị hai thanh niên đi xe máy không mũ bảo hiểm tát vào đầu01:20 Thực hư clip xe cứu thương chế còi "cố lên, sắp tới rồi" chạy ở TPHCM00:28
Thực hư clip xe cứu thương chế còi "cố lên, sắp tới rồi" chạy ở TPHCM00:28 Xác minh clip 2 tài xế ô tô cầm kiếm dọa chém nhau giữa đường ở TPHCM00:52
Xác minh clip 2 tài xế ô tô cầm kiếm dọa chém nhau giữa đường ở TPHCM00:52 Ô tô đâm sập cửa nhà dân ở Thái Nguyên, cuốn người đàn ông vào gầm08:05
Ô tô đâm sập cửa nhà dân ở Thái Nguyên, cuốn người đàn ông vào gầm08:05 Thông tin về clip CSGT quật ngã người đàn ông ở TPHCM07:30
Thông tin về clip CSGT quật ngã người đàn ông ở TPHCM07:30 Vụ trâu húc 2 người nhập viện ở Bình Chánh: Do nạn nhân chọc ghẹo trâu09:16
Vụ trâu húc 2 người nhập viện ở Bình Chánh: Do nạn nhân chọc ghẹo trâu09:16 Lại xuất hiện clip tài xế dùng nắm đấm để 'nói chuyện' ở Hà Nội13:50
Lại xuất hiện clip tài xế dùng nắm đấm để 'nói chuyện' ở Hà Nội13:50 Công an thông tin nguyên nhân người đàn ông đấm tài xế ô tô ở quận Hoàn Kiếm10:10
Công an thông tin nguyên nhân người đàn ông đấm tài xế ô tô ở quận Hoàn Kiếm10:10 Phú bà rinh hết gia sản 'dằn mặt' mẹ chồng, ngày cưới kéo tới 3 thứ khủng?04:38
Phú bà rinh hết gia sản 'dằn mặt' mẹ chồng, ngày cưới kéo tới 3 thứ khủng?04:38Tiêu điểm
Tin đang nóng
Tin mới nhất

Gặp sạt lở đất trên đường đi trồng ngô, mẹ trọng thương, con trai tử vong

Cà Mau: Dông lốc làm hư hỏng nhiều nhà cửa

Quảng Ngãi huy động hàng trăm bộ đội, người dân gia cố khẩn cấp bờ biển Mỹ Khê

Hỏa hoạn ở Thái Nguyên, phát hiện một thi thể dưới gầm giường

Xây đường sắt 8,37 tỷ USD nối với Trung Quốc: "Tiến độ, thời gian rất gấp"

Nghệ An chỉ đạo tạm dừng xây dựng, sửa chữa trụ sở hành chính cấp huyện

Vụ tai nạn khiến 3 người tử vong ở Hà Nội: Tài xế ô tô vi phạm nồng độ cồn

Hiện trường vụ sạt lở đá ở Thanh Hóa khiến nhiều người tháo chạy trong đêm

Nữ tài xế đậu xe Mercedes 'kì lạ' ở TP Nha Trang

Nghe tiếng động lớn, cặp vợ chồng lao ra khỏi nhà, thoát chết trong gang tấc

Xe cấp cứu chở bệnh nhân cháy dữ dội trên quốc lộ ở Bình Dương

Xử lý dầu vón cục trôi dạt vào bờ biển Quảng Nam
Có thể bạn quan tâm

Công an mời làm việc 5 thanh thiếu niên cầm ba chỉa ‘dạo phố’ ở Thủ Đức
Nhóm thanh thiếu niên khai nhận số ba chỉa cầm “dạo phố” ở Thủ Đức là vừa mua được trên mạng, đang mang đi cất giấu.
Sao nam Vbiz hẹn hò "ghệ mới" hot girl 2K, còn chuyển khoản tặng bạn gái kèm lời nhắn "sến đến ngỡ ngàng"
Sao việt
21:45:47 26/02/2025
Bà Trương Mỹ Lan kháng cáo, tòa sắp xử phúc thẩm vụ Vạn Thịnh Phát giai đoạn 2
Pháp luật
21:39:16 26/02/2025
Mẹ Bắp nói gì về thông tin "chuyển 2 tỷ đồng về quê cho ông bà ngoại trả nợ"?
Netizen
21:35:50 26/02/2025
HYBE vượt mốc doanh thu 1,4 tỷ USD năm thứ hai liên tiếp
Nhạc quốc tế
21:28:24 26/02/2025
Được mùa nhạc phim
Nhạc việt
21:24:13 26/02/2025
Nghị sỹ Mỹ: Tổng thống Trump có thể chấp nhận đầu tư từ Trung Quốc
Thế giới
21:23:59 26/02/2025
Lee Min Ho đang gặp chuỗi thất bại?
Hậu trường phim
21:20:56 26/02/2025
8 ngày sau khi sinh con, vợ thủ môn Lâm Tây đã đi tập gym, sắp lấy lại vóc dáng sexy nhất làng bóng đá?
Sao thể thao
21:08:26 26/02/2025
Psy được trường đại học hàng đầu Hàn Quốc vinh danh
Sao châu á
21:05:47 26/02/2025
 Chung cư Đồng Phát thêm 3 ca mắc COVID-19 mới, Hà Nội có 9 ca trong ngày 20/9
Chung cư Đồng Phát thêm 3 ca mắc COVID-19 mới, Hà Nội có 9 ca trong ngày 20/9
 Nhiều tỉnh xin tiêm vắc xin Nanocovax, Bộ Y tế không đồng ý
Nhiều tỉnh xin tiêm vắc xin Nanocovax, Bộ Y tế không đồng ý Kết quả thử nghiệm ban đầu khả quan của vắc xin Nanocovax
Kết quả thử nghiệm ban đầu khả quan của vắc xin Nanocovax Xem xét cấp phép khẩn cấp vaccine Nanocovax
Xem xét cấp phép khẩn cấp vaccine Nanocovax
 Bộ Y tế họp khẩn về tiến độ thử nghiệm vắc xin Nanocovax
Bộ Y tế họp khẩn về tiến độ thử nghiệm vắc xin Nanocovax Nanogen xin cấp phép khẩn cấp cho vaccine Nanocovax sản xuất tại TP.HCM
Nanogen xin cấp phép khẩn cấp cho vaccine Nanocovax sản xuất tại TP.HCM Vụ bị xe máy tông tử vong khi cứu người gặp nạn: Cách nào đảm bảo an toàn?
Vụ bị xe máy tông tử vong khi cứu người gặp nạn: Cách nào đảm bảo an toàn? Xe đầu kéo lao xuống vực sâu ở Sơn La, 2 người tử vong
Xe đầu kéo lao xuống vực sâu ở Sơn La, 2 người tử vong Bí ẩn chiếc thẻ thanh tra xây dựng của người bị CSGT khống chế ở TPHCM
Bí ẩn chiếc thẻ thanh tra xây dựng của người bị CSGT khống chế ở TPHCM Xe cứu thương bốc cháy trên đường chở bệnh nhân chuyển viện
Xe cứu thương bốc cháy trên đường chở bệnh nhân chuyển viện Nhóm phụ nữ vô tư dừng xe 'buôn chuyện' giữa đường: Sự tùy tiện nguy hiểm
Nhóm phụ nữ vô tư dừng xe 'buôn chuyện' giữa đường: Sự tùy tiện nguy hiểm Nam thanh niên tử vong thương tâm trên đường đi làm
Nam thanh niên tử vong thương tâm trên đường đi làm Thực hư cánh kỳ đài khu tưởng niệm liệt sĩ ở Gia Lai bị ngã đổ
Thực hư cánh kỳ đài khu tưởng niệm liệt sĩ ở Gia Lai bị ngã đổ Làm rõ nguyên nhân chợ ở Tuyên Quang cháy lớn, nhiều kiot bị thiêu rụi
Làm rõ nguyên nhân chợ ở Tuyên Quang cháy lớn, nhiều kiot bị thiêu rụi Sao nam "mất tích" khỏi Vbiz: Nghi chia tay đàn chị hơn 14 tuổi và gây xôn xao vì 1 tờ giấy nợ
Sao nam "mất tích" khỏi Vbiz: Nghi chia tay đàn chị hơn 14 tuổi và gây xôn xao vì 1 tờ giấy nợ Sau livestream sao kê của TikToker Phạm Thoại, người ủng hộ "xin lại tiền"
Sau livestream sao kê của TikToker Phạm Thoại, người ủng hộ "xin lại tiền"
 Mẹ Bắp có bao nhiêu tài khoản nhận tiền từ thiện?
Mẹ Bắp có bao nhiêu tài khoản nhận tiền từ thiện? Tổng thống Trump tuyên bố ngừng viện trợ quân sự cho Kiev
Tổng thống Trump tuyên bố ngừng viện trợ quân sự cho Kiev Video hé lộ tình trạng 2 con của Từ Hy Viên sau vụ nhập viện cấp cứu
Video hé lộ tình trạng 2 con của Từ Hy Viên sau vụ nhập viện cấp cứu Bích Ngọc lên tiếng về nghi vấn "phim giả tình thật" với Thuận Nguyễn
Bích Ngọc lên tiếng về nghi vấn "phim giả tình thật" với Thuận Nguyễn Con gái mất 100 ngày, nam NSƯT từ Mỹ về Việt Nam thắp hương: "Ba đã về với con rồi"
Con gái mất 100 ngày, nam NSƯT từ Mỹ về Việt Nam thắp hương: "Ba đã về với con rồi" Cảnh nam sinh ngồi bấm điện thoại khi bà bầu đứng suốt 30 phút trên tàu metro số 1 gây tranh cãi dữ dội
Cảnh nam sinh ngồi bấm điện thoại khi bà bầu đứng suốt 30 phút trên tàu metro số 1 gây tranh cãi dữ dội Ảnh nét căng ăn hỏi thủ môn Văn Toản: Dàn xe rước dâu "khủng", đàng gái nhà to nhất phố gia thế không phải vừa
Ảnh nét căng ăn hỏi thủ môn Văn Toản: Dàn xe rước dâu "khủng", đàng gái nhà to nhất phố gia thế không phải vừa So sánh nhan sắc Lâm Tâm Như ở tuổi 49 mới hiểu thế nào là sự khác biệt của lão hoá nhân tạo và tự nhiên
So sánh nhan sắc Lâm Tâm Như ở tuổi 49 mới hiểu thế nào là sự khác biệt của lão hoá nhân tạo và tự nhiên Biến căng: Cảnh sát khám nhà khẩn, bắt giữ nam diễn viên hàng đầu nghi xúi giục tra tấn người đến chết
Biến căng: Cảnh sát khám nhà khẩn, bắt giữ nam diễn viên hàng đầu nghi xúi giục tra tấn người đến chết Thu Hoà - mẹ Bắp xuất hiện trên livestream, oà khóc khi quay con đang nằm trên giường bệnh
Thu Hoà - mẹ Bắp xuất hiện trên livestream, oà khóc khi quay con đang nằm trên giường bệnh Doanh nhân Mailisa lên tiếng vụ sao kê của mẹ bé Bắp: Đó là để nói với con nít!
Doanh nhân Mailisa lên tiếng vụ sao kê của mẹ bé Bắp: Đó là để nói với con nít! Náo loạn MXH: Phạm Băng Băng bí mật kết hôn với ông trùm giàu bậc nhất Đông Nam Á để cứu vớt sự nghiệp?
Náo loạn MXH: Phạm Băng Băng bí mật kết hôn với ông trùm giàu bậc nhất Đông Nam Á để cứu vớt sự nghiệp? Hot nhất hôm nay: Bạn gái Huỳnh Hiểu Minh sinh con gái, Angelababy lo sốt vó vì quyền thừa kế của quý tử thay đổi?
Hot nhất hôm nay: Bạn gái Huỳnh Hiểu Minh sinh con gái, Angelababy lo sốt vó vì quyền thừa kế của quý tử thay đổi? Đơn vị tổ chức quyên góp từ thiện Give.Asia thông báo dừng chiến dịch ủng hộ bé Bắp
Đơn vị tổ chức quyên góp từ thiện Give.Asia thông báo dừng chiến dịch ủng hộ bé Bắp Triệu Lệ Dĩnh hoảng loạn vì bị vây kín giữa biển người, nhan sắc thật qua "cam thường" mới gây choáng
Triệu Lệ Dĩnh hoảng loạn vì bị vây kín giữa biển người, nhan sắc thật qua "cam thường" mới gây choáng