Giả mạo hồ sơ, 5 loại thuốc bị thu hồi giấy đăng ký lưu hành
Căn cứ kết quả hậu kiểm xác thực giấy tờ pháp lý trong hồ sơ đăng ký thuốc, Cục Quản lý Dược đã thu hồi giấy đăng ký lưu hành 5 loại thuốc tại Việt Nam.
Cục Quản lý Dược (Bộ Y tế) vừa có quyết định về việc thu hồi Giấy đăng ký lưu hành thuốc tại Việt Nam đối với 5 thuốc bao gồm: Thuốc Pompezo 40mg; hoạt chất, hàm lượng: Esomeprazol (dưới dạng vi hạt Esomeprazol magnesi dihydrat) 40mg; dạng bào chế: viên nang cứng; số đăng ký: VN-22822-21.
Nhiều loại thuốc bị cơ quan quản lý thu hồi Giấy đăng ký lưu hành thuốc tại Việt Nam -Ảnh minh hoạ
Thuốc Pompezo 20mg; hoạt chất, hàm lượng: Esomeprazol (dưới dạng vi hạt Esomeprazol magnesi dihydrat) 20mg; dạng bào chế: viên nang cứng; số đăng ký: VN-22821-21.
Video đang HOT
Thuốc Choludexan 300mg: Choludexan 300mg; hoạt chất, hàm lượng: Acid ursodeoxycholic 300mg; dạng bào chế: viên nang cứng; số đăng ký: VN-22820-21.
Thuốc Etacid 0,05%; hoạt chất, hàm lượng: mỗi liều xịt chứa: Mometason furoat 50mcg; dạng bào chế: hỗn dịch xịt mũi; số đăng ký: VN-22821-21.
4 loại thuốc trên do Công ty cổ phần Dược phẩm Minh Kỳ (địa chỉ: Số 1-3, Lô C, Cư xá Lạc Long Quân, P.5, Q.11, TP HCM – Việt Nam) đăng ký; do World Medicine Ilac San. ve Tic. A.S. (Đ/c: 15 Temmuz Mah. Cami Yolu Cad. No 50, Gneşli, Bagcilar/ Istanbul – Turkey) sản xuất.
Thuốc Ulsepan 40mg; hoạt chất, hàm lượng: Pantoprazole (dạng Pantoprazole natri sesquihydrate) 40mg; dạng bào chế: viên nén bao tan trong ruột; số đăng ký: VN-22123-19.
Thuốc này do Công ty TNHH MTV DP Altus (địa chỉ: Số 49, đường 79, Phường Tân Quy, Quận 7, TP HCM – Việt Nam) đăng ký; do World Medicine Ilac San. ve Tic. A.S. (Đ/c: 15 Temmuz Mah. Cami Yolu Cad. No 50, Gneşli, Bagcilar/ Istanbul – Turkey) sản xuất.
Theo quyết định của Cục Quản lý Dược, các loại thuốc nêu trên bị thu hồi giấy đăng ký lưu hành thuốc tại Việt Nam do vi phạm Điểm d, Khoản 1 Điều 58 Luật Dược: Giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc được cấp dựa trên hồ sơ giả mạo.
Cục Quản lý Dược yêu cầu cơ sở đăng ký thuốc, nhập khẩu thuốc phối hợp với cơ sở sản xuất có thuốc ban hành kèm theo Quyết định này gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc, tiến hành thu hồi toàn bộ các mặt hàng thuốc nêu trên, gửi báo cáo thu hồi về Cục Quản lý Dược trước ngày 15-6.
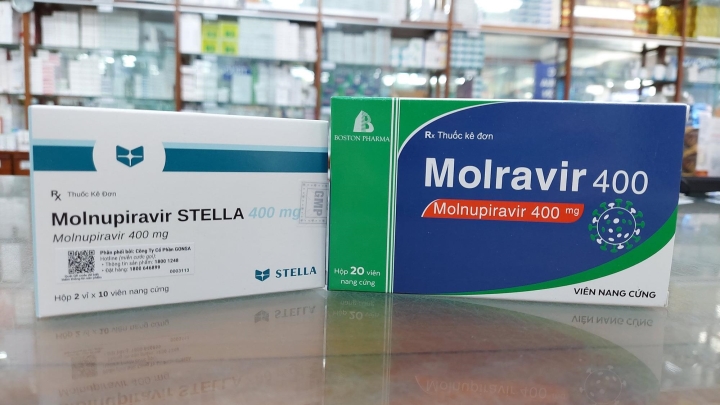
Thuốc Molnupiravir thứ 4 được cấp phép tại Việt Nam
Cục Quản lý Dược (Bộ Y tế) vừa quyết định cấp phép lưu hành thêm 1 loại thuốc Molnupiravir trong điều trị COVID-19 tại Việt Nam.
Thuốc Molnupiravir Stella 200 mg; hàm lượng Molnupiravir 200mg, dạng viên nang cứng, tuổi thọ 6 tháng, hộp 4 vỉ x 10 viên. Số đăng ký là SĐK: VD3-174-22 của Công ty TNHH liên doanh Stellapharm - Chi nhánh 1 (Stellapharm J.V. Co., Ltd. - Branch 1) sản xuất và đăng ký.
Việc cấp phép cho loại thuốc này có hiệu lực 3 năm từ ngày ký ban hành quyết định.
Thuốc Molnupiravir 400, một trong 4 thuốc được cấp phép lưu hành tại Việt Nam trong điều trị COVID-19. (Ảnh: Báo Chính phủ)
Như vậy, đến nay đã có 4 loại thuốc Molnupiravir - điều trị COVID-19 sản xuất trong nước được cấp phép lưu hành. Hồi tháng 2/2022, Cục Quản lý Dược cũng cấp phép cho 3 loại thuốc Molnupiravir khác, đó là Molravir 400: hàm lượng Molnupiravir 400 mg, dạng viên nang cứng, tuổi thọ 6 tháng, do Công ty Cổ phần dược phẩm Boston Việt Nam sản xuất.
Movinavir hàm lượng 200 mg Molnupiravir, dạng viên nang cứng, tuổi thọ 6 tháng, do Công ty cổ phần hóa dược phẩm Mekophar sản xuất. Molnuporavir Stella 400: hàm lượng 400 mg Molnupiravir, dạng viện nang cứng, tuổi thọ 8 tháng, do Công ty TNHH Liên doanh Stellapharm - chi nhánh 1 sản xuất.
Sau khi cấp phép cho thuốc Molnupiravir thứ 4, Cục Quản lý Dược yêu cầu các cơ sở sản xuất và đăng ký thuốc sản xuất theo đúng hồ sơ, tài liệu đăng ký với Bộ Y tế. Các đơn vị cần phối hợp với các cơ sở điều trị thực hiện đúng các quy định hiện hành về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn của thuốc trên người Việt Nam và tổng hợp, báo cáo theo quy định.
Cục Quản lý Dược cũng yêu cầu các đơn vị tăng cường theo dõi, giám sát, phát hiện các trường hợp xảy ra phản ứng có hại của thuốc (nếu có), gửi báo cáo về Trung tâm Quốc gia về thông tin thuốc và theo dõi phản ứng có hại của thuốc (Hà Nội) hoặc Trung tâm khu vực về thông tin thuốc và theo dõi phản ứng có hại của thuốc (TP.HCM) theo quy định.
Phát hiện thuốc Molnupiravir giả ở Thụy Sĩ ghi 'sản xuất tại Bình Dương'  Tối 5-5, Cục Quản lý dược (Bộ Y tế) có cảnh báo khẩn về việc phát hiện thuốc giả Molnupiravir tại Thụy Sĩ có thông tin tiếng Việt không dấu trên nhãn ở phần nơi sản xuất. Hình ảnh thuốc giả Molnupiravir phát hiện tại Thụy Sĩ - Ảnh: Cục Quản lý dược cung cấp Trước đó, Cục Quản lý dược cho biết...
Tối 5-5, Cục Quản lý dược (Bộ Y tế) có cảnh báo khẩn về việc phát hiện thuốc giả Molnupiravir tại Thụy Sĩ có thông tin tiếng Việt không dấu trên nhãn ở phần nơi sản xuất. Hình ảnh thuốc giả Molnupiravir phát hiện tại Thụy Sĩ - Ảnh: Cục Quản lý dược cung cấp Trước đó, Cục Quản lý dược cho biết...
 Sự cố chấn động điền kinh: VĐV bị đối thủ vụt gậy vào đầu, nghi vỡ hộp sọ02:05
Sự cố chấn động điền kinh: VĐV bị đối thủ vụt gậy vào đầu, nghi vỡ hộp sọ02:05 TP.HCM: Xôn xao clip nhóm người ngang nhiên chặn xe kiểm tra giấy tờ06:11
TP.HCM: Xôn xao clip nhóm người ngang nhiên chặn xe kiểm tra giấy tờ06:11 Nhân viên y tế bị đánh hội đồng ngay tại nơi làm việc00:17
Nhân viên y tế bị đánh hội đồng ngay tại nơi làm việc00:17 Kế hoạch bắt cóc người đàn ông Trung Quốc, tống tiền 10 tỷ đồng ở TPHCM13:48
Kế hoạch bắt cóc người đàn ông Trung Quốc, tống tiền 10 tỷ đồng ở TPHCM13:48 Ông Trump gợi ý ông Zelensky có thể ra đi vì từ chối thỏa thuận08:44
Ông Trump gợi ý ông Zelensky có thể ra đi vì từ chối thỏa thuận08:44 Ông Trump muốn đàm phán lại biên giới Mỹ - Canada07:42
Ông Trump muốn đàm phán lại biên giới Mỹ - Canada07:42 Trung Quốc gửi thông điệp cứng rắn đến Đài Loan08:38
Trung Quốc gửi thông điệp cứng rắn đến Đài Loan08:38 Ông Trump phát biểu tại quốc hội, một nghị sĩ bị mời ra ngoài09:32
Ông Trump phát biểu tại quốc hội, một nghị sĩ bị mời ra ngoài09:32 Ông Zelensky nói gì về chuyện tổ chức bầu cử ở Ukraine?10:13
Ông Zelensky nói gì về chuyện tổ chức bầu cử ở Ukraine?10:13 Hàn Quốc: Hàng chục ngàn người xuống đường sau khi ông Yoon Suk Yeol được thả01:03
Hàn Quốc: Hàng chục ngàn người xuống đường sau khi ông Yoon Suk Yeol được thả01:03 Thái Lan nghiên cứu ý tưởng xây tường biên giới với Campuchia08:52
Thái Lan nghiên cứu ý tưởng xây tường biên giới với Campuchia08:52Tiêu điểm
Tin đang nóng
Tin mới nhất

Điều gì xảy ra khi luôn uống một cốc cà phê mỗi sáng?

Bánh mì kết hợp cùng loại gia vị quen thuộc này, càng ăn càng sống thọ

8 loại thực phẩm giàu chất xơ từ tự nhiên

Tiếp sức người mắc bệnh hiếm

Ngộ độc thực phẩm, xử trí thế nào?

Ăn nhiều loại rau này sẽ hỗ trợ phòng ung thư

Cách sử dụng mướp đắng khi bị bệnh đái tháo đường

Ăn cá bổ dưỡng nhưng tránh 4 loại có thể gây ung thư

Nguyên nhân khiến da thường xuyên bị khô, ngứa
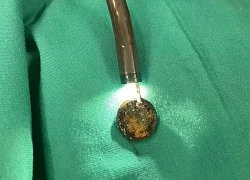
Hà Nội: Bé 4 tuổi thoát nguy cơ thủng thực quản do nuốt phải pin cúc áo

Vì sao hoa cúc và kỷ tử là thuốc quý của phụ nữ?

8 thói quen sau bữa tối giúp tiêu hóa nhanh hơn
Có thể bạn quan tâm

Tưởng niệm 14 năm thảm họa động đất, sóng thần ở Nhật Bản
Thế giới
19:01:41 11/03/2025
Clip: Tài xế "liều mạng" chạy ngược chiều, lạng lách tránh cảnh sát giao thông, cảnh tượng sau đó khiến ai cũng bất ngờ!
Netizen
18:22:50 11/03/2025
Kim Soo Hyun bị đào lại hình ảnh đi xem concert cùng 1 nữ idol, tiện thể xin số của gái lạ
Sao châu á
18:16:56 11/03/2025
'Bóc giá' nhẫn cưới của hot girl Việt đời đầu và chồng thiếu gia
Phong cách sao
18:14:28 11/03/2025
5 bộ trang phục thời thượng để có vòng eo nhỏ nhắn
Thời trang
18:09:42 11/03/2025
Tử vi hằng ngày - Xem tử vi vui 12 con giáp ngày 11.3.2025
Trắc nghiệm
17:55:19 11/03/2025
Sao nữ đẹp có tiếng tự hủy nhan sắc, diện mạo gây giật mình
Hậu trường phim
17:50:31 11/03/2025
Thời kỳ khủng hoảng nhất của Sulli có liên quan gì đến Kim Soo Hyun?
Nhạc quốc tế
17:44:42 11/03/2025
Tiểu thư Doãn Hải My đang ngồi make-up, Đoàn Văn Hậu ghé lại hôn cực ngọt, gương mặt kém sắc gây chú ý
Sao thể thao
17:04:49 11/03/2025
 Cứ đến kỳ thi lại đau bụng, bác sĩ nêu nguyên nhân khiến gia đình bất ngờ
Cứ đến kỳ thi lại đau bụng, bác sĩ nêu nguyên nhân khiến gia đình bất ngờ Sốt bao nhiêu độ mới nên uống thuốc hạ sốt?
Sốt bao nhiêu độ mới nên uống thuốc hạ sốt?
 Nóng: Cục Quản lý Dược thu hồi 4 loại thuốc điều trị tăng mỡ máu chống chỉ định với người châu Á
Nóng: Cục Quản lý Dược thu hồi 4 loại thuốc điều trị tăng mỡ máu chống chỉ định với người châu Á Thu hồi 4 loại thuốc điều trị mỡ máu
Thu hồi 4 loại thuốc điều trị mỡ máu Bộ Y tế công bố chi tiết giá thuốc Molnupiravir "made in Việt Nam"
Bộ Y tế công bố chi tiết giá thuốc Molnupiravir "made in Việt Nam" Cấp phép 3 thuốc Molnupiravir sản xuất trong nước
Cấp phép 3 thuốc Molnupiravir sản xuất trong nước Tăng cường kiểm tra, giám sát chất lượng thuốc điều trị bệnh nhân Covid-19
Tăng cường kiểm tra, giám sát chất lượng thuốc điều trị bệnh nhân Covid-19 Cục Quản lý Dược: 2 công ty dược nước ngoài đồng ý nhượng quyền sản xuất thuốc điều trị COVID-19
Cục Quản lý Dược: 2 công ty dược nước ngoài đồng ý nhượng quyền sản xuất thuốc điều trị COVID-19 Chảy máu vùng miệng không ngừng, cô gái trẻ được chẩn đoán suy thận giai đoạn cuối
Chảy máu vùng miệng không ngừng, cô gái trẻ được chẩn đoán suy thận giai đoạn cuối Phát hiện phương pháp điều trị đầy hứa hẹn cho ung thư gan ác tính
Phát hiện phương pháp điều trị đầy hứa hẹn cho ung thư gan ác tính Viêm tuyến giáp Hashimoto có biểu hiện như thế nào?
Viêm tuyến giáp Hashimoto có biểu hiện như thế nào? Gia tăng các ca cấp cứu tại các bệnh viện trong tỉnh
Gia tăng các ca cấp cứu tại các bệnh viện trong tỉnh Nữ sinh 15 tuổi thủng tá tràng sau cơn đau dữ dội vùng thượng vị
Nữ sinh 15 tuổi thủng tá tràng sau cơn đau dữ dội vùng thượng vị U40 gặp dấu hiệu này chứng tỏ xương đang lão hóa nhanh, dễ mắc bệnh
U40 gặp dấu hiệu này chứng tỏ xương đang lão hóa nhanh, dễ mắc bệnh Loại rau gia vị ai cũng từng ăn, là 'khắc tinh' của sỏi thận lại siêu bổ dưỡng
Loại rau gia vị ai cũng từng ăn, là 'khắc tinh' của sỏi thận lại siêu bổ dưỡng Những thuốc nào cần uống sau khi bị đột quỵ?
Những thuốc nào cần uống sau khi bị đột quỵ?
 Lê Phương gây hoang mang khi đăng status sau tang lễ Quý Bình, nhiều nghệ sĩ vào bình luận ẩn ý
Lê Phương gây hoang mang khi đăng status sau tang lễ Quý Bình, nhiều nghệ sĩ vào bình luận ẩn ý
 NÓNG: Lộ ảnh Kim Soo Hyun hôn má Kim Sae Ron và tin nhắn van xin thống khổ gây sốc của cố diễn viên
NÓNG: Lộ ảnh Kim Soo Hyun hôn má Kim Sae Ron và tin nhắn van xin thống khổ gây sốc của cố diễn viên
 Lê Phương và vợ doanh nhân của cố nghệ sĩ Quý Bình có mối quan hệ thế nào?
Lê Phương và vợ doanh nhân của cố nghệ sĩ Quý Bình có mối quan hệ thế nào? Phóng to hết cỡ bức ảnh chồng và con gái trong phòng ngủ, vợ đau lòng nhìn thứ anh cầm trên tay
Phóng to hết cỡ bức ảnh chồng và con gái trong phòng ngủ, vợ đau lòng nhìn thứ anh cầm trên tay Hoá ra Kim Sae Ron công khai ủng hộ Kim Soo Hyun khi mới 13 tuổi, bắt đầu bị thao túng từ đây?
Hoá ra Kim Sae Ron công khai ủng hộ Kim Soo Hyun khi mới 13 tuổi, bắt đầu bị thao túng từ đây? Lê Phương chia sẻ ẩn ý sau tang lễ Quý Bình, netizen nghi ngờ liên quan đến vợ của cố nghệ sĩ
Lê Phương chia sẻ ẩn ý sau tang lễ Quý Bình, netizen nghi ngờ liên quan đến vợ của cố nghệ sĩ Drama dồn dập: "Ông hoàng" Châu Kiệt Luân đánh bài thua hơn 3.500 tỷ, phải thế chấp 3 biệt thự và 1 máy bay riêng?
Drama dồn dập: "Ông hoàng" Châu Kiệt Luân đánh bài thua hơn 3.500 tỷ, phải thế chấp 3 biệt thự và 1 máy bay riêng?
 Bị chỉ trích "khóc không có giọt nước mắt" trong đám tang Quý Bình, một nữ nghệ sĩ lên tiếng
Bị chỉ trích "khóc không có giọt nước mắt" trong đám tang Quý Bình, một nữ nghệ sĩ lên tiếng
 Nóng: Kim Soo Hyun trực tiếp lên tiếng về tin hẹn hò Kim Sae Ron 15 tuổi, quấy rối cố diễn viên
Nóng: Kim Soo Hyun trực tiếp lên tiếng về tin hẹn hò Kim Sae Ron 15 tuổi, quấy rối cố diễn viên 'Mỹ nhân phim hành động' Phi Ngọc Ánh mắc ung thư
'Mỹ nhân phim hành động' Phi Ngọc Ánh mắc ung thư
 Nguyễn Đình Như Vân đăng quang Miss Global, BTC xin lỗi vì ồn ào 'đường lưỡi bò'
Nguyễn Đình Như Vân đăng quang Miss Global, BTC xin lỗi vì ồn ào 'đường lưỡi bò' Viên Minh hiếm hoi tung ảnh hạnh phúc bên Công Phượng và cậu quý tử, nhan sắc tiểu thư trâm anh thế phiệt gây chú ý
Viên Minh hiếm hoi tung ảnh hạnh phúc bên Công Phượng và cậu quý tử, nhan sắc tiểu thư trâm anh thế phiệt gây chú ý