Gia Lai được Bộ Y tế chọn thử nghiệm lâm sàng thuốc Molnupiravir
Gia Lai cùng với Lâm Đồng vừa được Bộ Y tế phê duyệt bổ sung vào chương trình sử dụng thuốc Molnupiravir có kiểm soát tại cộng đồng cho người mắc Covid-19 thể nhẹ.
Theo đó, triển khai quyết định ngày 18.11 của Bộ Y tế về việc phê duyệt bổ sung đề cương nghiên cứu thử nghiệm lâm sàng; Bộ Y tế đã phê duyệt bổ sung đề cương nghiên cứu “Đánh giá chương trình sử dụng thuốc Molnupiravir có kiểm soát tại cộng đồng cho người mắc Covid-19 thể nhẹ ở một số tỉnh tại Việt Nam”.
Gia Lai cùng với Lâm Đồng là 1 trong 2 địa phương được bổ sung trong đợt này. Đối tượng nghiên cứu tại tỉnh Gia Lai là 1.000 người. Hiện Sở Y tế Gia Lai đang khẩn trương triển khai, quản lý, tổ chức nghiên cứu thực hiện tại địa phương.
Tiêm vắc xin phòng Covid-19 cho học sinh tại TP.Pleiku (Gia Lai). Ảnh TRẦN HIẾU
Video đang HOT
Tính từ ngày 5.12 đến 10 giờ ngày 6.12, tỉnh Gia Lai đã lấy mẫu xét nghiệm cho 4.899 người; trong đó 87 mẫu nghi ngờ của 296 người đang xét nghiệm lại; ghi nhận 169 trường hợp dương tính với Covid-19, nâng tổng số ca dương tính lên 4.238 trường hợp với 10 ca tử vong. Hiện có 1.723 trường hợp dương tính đang điều trị.
Trước tình hình dịch diễn biến phức tạp, có nhiều ca bệnh trong cộng đồng, Ban Chỉ đạo phòng chống dịch Covid-19 tỉnh Gia Lai đề nghị người dân hạn chế ra ngoài tỉnh nếu không thật sự cần thiết; khi phát hiện người đi từ vùng dịch về, người nhập cảnh vào địa phương… phải kịp thời thông báo cho chính quyền để kiểm tra.
Cục Quản lý Dược: 2 công ty dược nước ngoài đồng ý nhượng quyền sản xuất thuốc điều trị COVID-19
Cục Quản lý Dược, Bộ Y tế cho biết, Tập đoàn dược phẩm MSD của Mỹ và Công ty Pfizer đã có văn bản gửi Cục Quản lý Dược đồng ý nhượng quyền tự nguyện sản xuất thuốc điều trị COVID-19.
Cục Quản lý Dược (Bộ Y tế) vừa có các công văn gửi đến Hiệp Hội Doanh nghiệp dược Việt Nam về việc nhượng quyền tự nguyện sản xuất thuốc điều trị COVID-19 gồm thuốc kháng virus Molnupiravir và thuốc Paxlovid.
Theo đó, Cục Quản lý Dược đề nghị Hiệp Hội Doanh nghiệp Dược Việt Nam sớm thông báo đến các cơ sở sản xuất thuốc thành viên có nhu cầu liên hệ với Tập đoàn dược phẩm MSD hoặc MPP để nộp hồ sơ nhằm trở thành đối tác nhượng quyền tự nguyện sản xuất thuốc kháng virus Molnupiravir.
Thuốc kháng virus Molnupiravir đã và đang được sử dụng trong chương trình thí điểm điều trị bệnh nhân COVID-19 (F0) không triệu chứng hoặc triệu chứng nhẹ tại nhà và cộng đồng
Trước đó, ngày 1/11, Tập đoàn dược phẩm MSD có công văn thông báo đã ký thỏa thuận với Quỹ Bằng sáng chế thuốc (Meidcines patent pool-MPP). Theo đó, các cơ sở sản xuất muốn được nhượng quyền tự nguyện để sản xuất thuốc kháng virus Molnupiravir sẽ nộp hồ sơ tới MPP. Cùng đó, Cục Quản lý Dược cũng có công văn gửi Hiệp hội đề nghị Hiệp hội thông tin tới các cơ sở sản xuất thuốc thành viên có nhu cầu khẩn trương liên hệ với Công ty Pfizer hoặc MPP để nộp hồ sơ đề nghị trở thành đối tác nhượng quyền tự nguyện sản xuất thuốc điều trị COVID-19 Paxlovid (chứa phối hợp PF-07321332 và Ritonavir).
Tại văn bản này, Cục Quản lý Dược cho biết ngày 20/11 vừa qua, Cục đã có công văn gửi Công ty Pfizer đề nghị Công ty hỗ trợ các cơ sở sản xuất dược phẩm của Việt Nam trong việc trở thành đối tác nhượng quyền tự nguyện của Pfizer sản xuất thuốc chứa phối hợp PF-07321332 và Ritonavir khi nộp đơn đề nghị.
Phúc đáp lại, Công ty Pfizer thông tin là MPP đã cung cấp thông tin để cơ sở sản xuất liên hệ và đăng ký trực tiếp với MPP về việc để trở thành đối tác nhượng quyền tự nguyện của Pfizer sản xuất thuốc chứa phối hợp PF-07321332 và Ritonavir. Hạn cuối cùng nộp đơn là ngày 6/12 (6h chiều giờ Châu Âu)
Cục Quản lý Dược đề nghị Hiệp hội thông tin tới các cơ sở sản xuất thuốc thành viên có nhu cầu khẩn trương truy cập thông tin để đăng ký trở thành đối tác nhượng quyền tự nguyện sản xuất thuốc chứa phối hợp PF 07321332 và Ritonavir.
Cũng liên quan đến thuốc kháng virus điều trị COVID-19, thông tin của Bộ Y tế cho biết hiện có 5 công ty dược trong nước nộp hồ sơ sản xuất thuốc kháng virus Molnupiravir. Bộ Y tế đang xem xét để trình Chính phủ chấp thuận cho cấp phép trong tình huống phòng chống dịch khẩn cấp, với một số điều khoản về hồ sơ được rút gọn. Nếu được đồng ý, dự kiến có 5 số đăng ký được cấp cho 5 thuốc Molnupiravir do các công ty dược trong nước sản xuất.
Đối với thuốc điều trị cho bệnh nhân COVID-19 hiện nay, Thứ trưởng Bộ Y tế Nguyễn Trường Sơn thông tin tại hội nghị trực tuyến về công tác điều trị COVID-19 ngày 25/11 cho biết: trong thời gian qua thuốc kháng virus Molnupiravir đã được Bộ Y tế phân bổ đến các địa phương thực hiện thí điểm có kiểm soát chương trình thí điểm quản lý, chăm sóc F0 không triệu chứng tại nhà và cộng đồng với gần 250.000 liều được sử dụng.
Kết quả đánh giá sơ bộ sử dụng thuốc này bước đầu hết sức khả quan, tỷ lệ âm tính sau khi sử dụng Molnupiravir sau 5 ngày là từ 72 đến 93%, tỷ lệ khác biệt có ý nghĩa so với nhóm chứng. Ngoài ra, chúng ta đã giảm tỷ lệ tử vong 50% so với nhóm không sử dụng. Đây là kết quả hứa hẹn với những bệnh nhân nhiễm ngay từ đầu.
Ngoài ra, các thuốc tốt, hứa hẹn trong điều trị bệnh nhân nặng cũng được sử dụng như các thuốc kháng thể đơn dòng, đã đem lại thành công.
Bộ Y tế cũng chuẩn bị một số phương án về thuốc khác để phục vụ điều trị bệnh nhân COVID-19, như thuốc favipiravir (Avigan). Bộ Y tế đã có kế hoạch phân bổ cho các địa phương...
Ngoài ra, Bộ Y tế đã phân bổ cho một số tỉnh, thành phố 2.000 liều thuốc kháng thể kép vào điều trị bệnh nhân COVID-19 nặng. Các cơ sở y tế sẽ đưa vào sử dụng sớm nhất cho người bệnh nhằm nâng cao chất lượng điều trị, giảm tỷ lệ tử vong"- Thứ trưởng Nguyễn Trường Sơn thông tin.
Bộ Y tế thông tin về hiệu quả của thuốc Molnupiravir với bệnh Covid-19 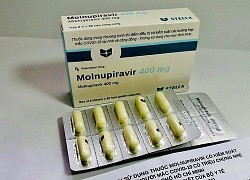 Kết quả báo cáo giữa kỳ tại 22 tỉnh, thành cho thấy thuốc Molnupiravir có tính an toàn cao, hiệu quả rõ rệt về giảm tải lượng virus, tỷ lệ chuyển nặng rất thấp và không có ca nào dẫn đến tử vong. Sáng 6/11, Bộ Y tế thông tin về Chương trình thí điểm điều trị có kiểm soát thuốc Molnupiravir cho...
Kết quả báo cáo giữa kỳ tại 22 tỉnh, thành cho thấy thuốc Molnupiravir có tính an toàn cao, hiệu quả rõ rệt về giảm tải lượng virus, tỷ lệ chuyển nặng rất thấp và không có ca nào dẫn đến tử vong. Sáng 6/11, Bộ Y tế thông tin về Chương trình thí điểm điều trị có kiểm soát thuốc Molnupiravir cho...
 Tạm giữ 6 nghi can liên quan vụ nam sinh bị nhóm người đánh đến nứt sọ01:11
Tạm giữ 6 nghi can liên quan vụ nam sinh bị nhóm người đánh đến nứt sọ01:11 Phút nghẹt thở giải cứu bé gái 9 tuổi bị khống chế bằng dao trên mái nhà00:24
Phút nghẹt thở giải cứu bé gái 9 tuổi bị khống chế bằng dao trên mái nhà00:24 Cảnh sát Việt Nam tìm thấy thi thể bé trai 10 tuổi trong vụ động đất ở Myanmar07:08
Cảnh sát Việt Nam tìm thấy thi thể bé trai 10 tuổi trong vụ động đất ở Myanmar07:08 'Hơn 1 tấn ketamin chưa lọt ra thị trường'06:41
'Hơn 1 tấn ketamin chưa lọt ra thị trường'06:41 Đối tượng uy hiếp bé gái ở Bắc Ninh vẫn 'ngáo đá' sau hơn 1 ngày bị bắt giữ03:23
Đối tượng uy hiếp bé gái ở Bắc Ninh vẫn 'ngáo đá' sau hơn 1 ngày bị bắt giữ03:23 Động đất mạnh ngang 334 bom nguyên tử ở Myanmar, số người chết vượt 1.00003:08
Động đất mạnh ngang 334 bom nguyên tử ở Myanmar, số người chết vượt 1.00003:08 Cảnh sát trích xuất camera tìm 2 xe phân khối lớn phóng như bay trên cao tốc00:12
Cảnh sát trích xuất camera tìm 2 xe phân khối lớn phóng như bay trên cao tốc00:12 Lạ lùng nhóm người chặn con hẻm quây lưới đánh bóng bàn ở TPHCM01:05
Lạ lùng nhóm người chặn con hẻm quây lưới đánh bóng bàn ở TPHCM01:05 Lý do Viện kiểm sát kháng nghị vụ tài xế đánh người trước Bệnh viện Từ Dũ08:27
Lý do Viện kiểm sát kháng nghị vụ tài xế đánh người trước Bệnh viện Từ Dũ08:27 Nga nói sẽ ký thỏa thuận biển Đen nếu Mỹ 'ra lệnh' cho Tổng thống Zelensky08:42
Nga nói sẽ ký thỏa thuận biển Đen nếu Mỹ 'ra lệnh' cho Tổng thống Zelensky08:42 Cháy rừng Hàn Quốc: 15 người chết, chùa 1.300 năm tuổi bị thiêu rụi01:15
Cháy rừng Hàn Quốc: 15 người chết, chùa 1.300 năm tuổi bị thiêu rụi01:15Tiêu điểm
Tin đang nóng
Tin mới nhất

Đẩy nhanh tiến độ tiêm vaccine phòng bệnh sởi, đáp ứng điều trị tốt nhất
Thời gian ủ bệnh của người mắc sởi
Những lưu ý giúp dùng thuốc điều trị ung thư vú hiệu quả
Cập nhật kỹ thuật tiên tiến trong điều trị bệnh lý tai mũi họng

Những lợi ích sức khỏe nếu uống trà matcha đúng cách
Các yếu tố nguy cơ khiến bạn mắc chứng ù tai

Mất cân bằng vi khuẩn ruột và những hệ lụy nguy hiểm

Người đàn ông sợ nước, sợ gió sau 3 tháng bị chó cắn
Nguy kịch vì nhiễm giun lươn lan tỏa

Công dụng của táo hấp với sức khỏe mà bạn chưa biết

Bệnh phổi tắc nghẽn mãn tính và những điều cần biết

Tác dụng của quả và lá đu đủ với bệnh ung thư
Có thể bạn quan tâm

Cặp đôi phim giả tình thật hot nhất mỗi mùa Cá tháng Tư: Nàng sexy hút hồn, chàng nổi danh cả châu Á
Sao châu á
23:28:16 01/04/2025
Sao Việt nổ toàn tin sốc trong hôm nay: Đoàn Thiên Ân và dàn hậu phát tin vui mệt nghỉ, 1 diễn viên thông báo mang thai với chồng ngoại quốc
Sao việt
23:22:16 01/04/2025
IU được gì sau thành công của 'Khi đời cho bạn quả quýt'
Hậu trường phim
23:19:58 01/04/2025
Trịnh Công Sơn và người định mệnh một đĩa cơm chia hai, cùng ngủ trên tờ báo cũ nhàu nát
Nhạc việt
22:59:02 01/04/2025
'Mật vụ phụ hồ' cấm khán giả dưới 18 tuổi, đối đầu trực tiếp bom tấn 'Địa đạo'
Phim âu mỹ
22:27:09 01/04/2025
Chồng cũ tới tham dự đám cưới, tôi bất ngờ khi thấy anh bật khóc lúc đôi bên trao nhẫn: Phản ứng của chú rể khiến tôi mãn nguyện
Góc tâm tình
22:22:43 01/04/2025
Hai thanh niên chủ mưu gây ra 9 vụ cướp ở Bình Dương
Pháp luật
22:01:54 01/04/2025
Nga tăng cường phục kích vào hậu cần Ukraine
Thế giới
22:00:09 01/04/2025
Bé gái 10 ngày tuổi bị bỏ rơi bên đường lúc rạng sáng
Tin nổi bật
21:32:51 01/04/2025
 Gia tăng trẻ em mắc Covid-19 nặng ở TPHCM, 40% F0 là độ tuổi lớp 1-9
Gia tăng trẻ em mắc Covid-19 nặng ở TPHCM, 40% F0 là độ tuổi lớp 1-9 Người vợ bị suy thận giai đoạn cuối hồi sinh nhờ quả thận của chồng
Người vợ bị suy thận giai đoạn cuối hồi sinh nhờ quả thận của chồng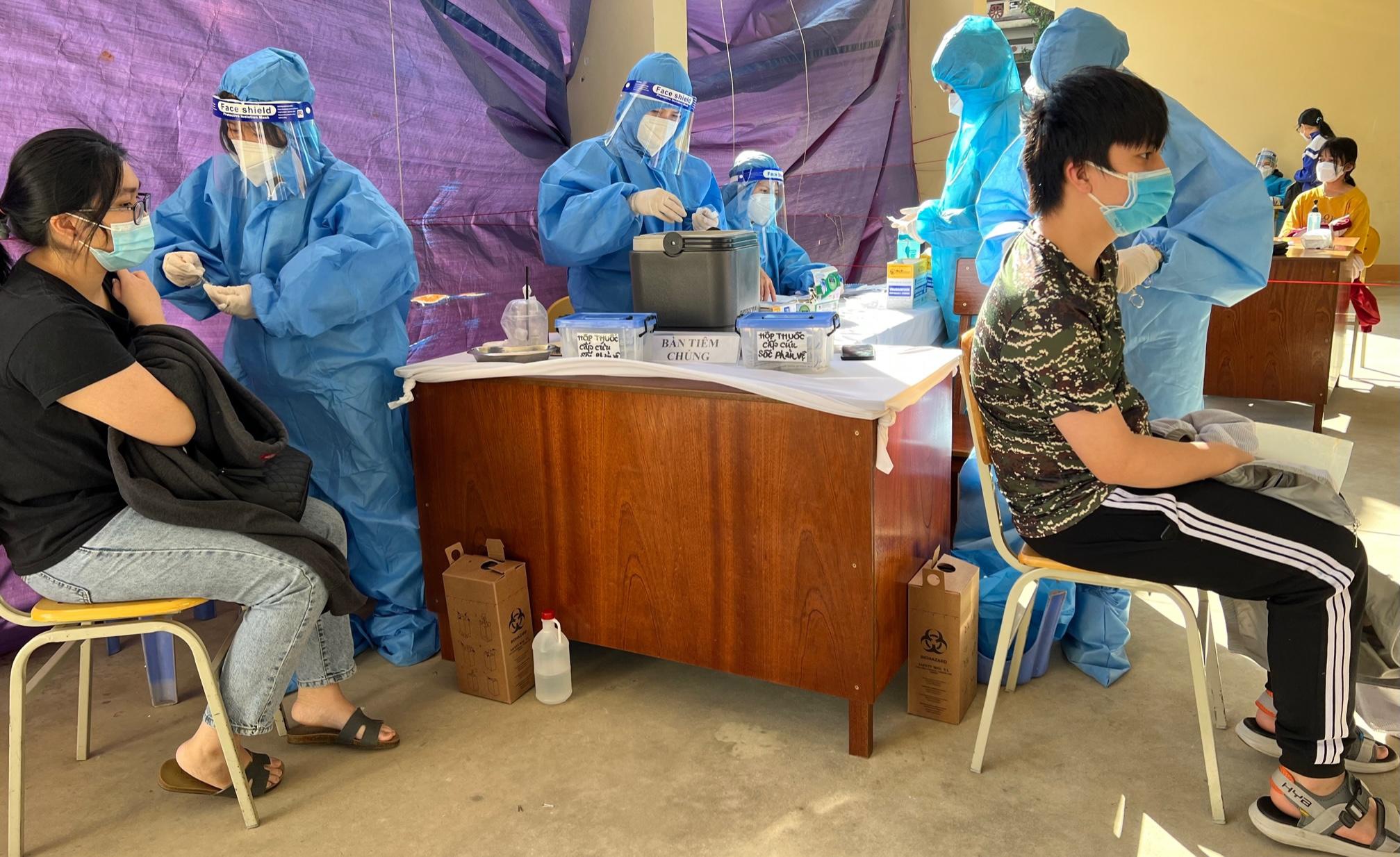

 Hai loại thuốc được Bộ Y tế chấp thuận đưa vào phác đồ điều trị COVID-19
Hai loại thuốc được Bộ Y tế chấp thuận đưa vào phác đồ điều trị COVID-19 TPHCM: Thuốc kháng virus đến với F0 được sử dụng như thế nào?
TPHCM: Thuốc kháng virus đến với F0 được sử dụng như thế nào? Thử nghiệm thuốc mới kháng virus cho F0 tại TP HCM
Thử nghiệm thuốc mới kháng virus cho F0 tại TP HCM F0 điều trị tại nhà sẽ được cấp hộp thuốc cơ bản và thực phẩm
F0 điều trị tại nhà sẽ được cấp hộp thuốc cơ bản và thực phẩm Thực hành các biện pháp đơn giản giúp phòng ngừa COVID-19
Thực hành các biện pháp đơn giản giúp phòng ngừa COVID-19 "Hãy từ bỏ thuốc lá vì sức khỏe của người thân yêu"
"Hãy từ bỏ thuốc lá vì sức khỏe của người thân yêu" Cỏ dại mọc hoang khắp Việt Nam, đào rễ lên phát hiện cả 'kho tiền'
Cỏ dại mọc hoang khắp Việt Nam, đào rễ lên phát hiện cả 'kho tiền' TP.HCM: Bác sĩ đi xe cấp cứu 2 bánh đến cứu cụ bà ngưng tim tại nhà
TP.HCM: Bác sĩ đi xe cấp cứu 2 bánh đến cứu cụ bà ngưng tim tại nhà 10 loại thực phẩm có nhiều canxi hơn một ly sữa
10 loại thực phẩm có nhiều canxi hơn một ly sữa Vụ 6 bệnh nhân ngộ độc rượu trái cây: Bác sĩ đưa ra lưu ý
Vụ 6 bệnh nhân ngộ độc rượu trái cây: Bác sĩ đưa ra lưu ý Uống nước lá ổi gây suy thận độ 3, thực hư thế nào?
Uống nước lá ổi gây suy thận độ 3, thực hư thế nào? Khoèo chân bẩm sinh: Nguyên nhân, triệu chứng, phòng ngừa và điều trị
Khoèo chân bẩm sinh: Nguyên nhân, triệu chứng, phòng ngừa và điều trị Từ chối tiêm vaccine sởi cho trẻ, nguy cơ tử vong rình rập
Từ chối tiêm vaccine sởi cho trẻ, nguy cơ tử vong rình rập TPHCM: Cấp cứu 6 người uống rượu trái cây khi đi du lịch, một ca nguy kịch
TPHCM: Cấp cứu 6 người uống rượu trái cây khi đi du lịch, một ca nguy kịch Kim Soo Hyun - Kim Sae Ron "1 trời 1 vực" khi đối mặt dàn phóng viên: "Bản lĩnh đàn ông đâu cả rồi?"
Kim Soo Hyun - Kim Sae Ron "1 trời 1 vực" khi đối mặt dàn phóng viên: "Bản lĩnh đàn ông đâu cả rồi?" NSND Thanh Tuấn đã tỉnh, NSND Lệ Thủy vui mừng xúc động
NSND Thanh Tuấn đã tỉnh, NSND Lệ Thủy vui mừng xúc động
 Top 4 nàng WAGs xinh đẹp còn sở hữu học vấn đáng nể: Doãn Hải My và 3 tiểu thư nhà trâm anh thế phiệt
Top 4 nàng WAGs xinh đẹp còn sở hữu học vấn đáng nể: Doãn Hải My và 3 tiểu thư nhà trâm anh thế phiệt Công an điều tra vụ hành hung bác sĩ sau câu nói "mày biết tao là ai không"
Công an điều tra vụ hành hung bác sĩ sau câu nói "mày biết tao là ai không" Nga lên tiếng về loại virus chưa xác định gây ra tình trạng ho ra máu
Nga lên tiếng về loại virus chưa xác định gây ra tình trạng ho ra máu Phim Việt đỉnh nhất hiện tại gây bão MXH ngay khi vừa ra mắt bị so sánh, nam chính nói điều khiến ai cũng phục
Phim Việt đỉnh nhất hiện tại gây bão MXH ngay khi vừa ra mắt bị so sánh, nam chính nói điều khiến ai cũng phục
 Cho mượn xe rồi bị mang đi cầm cố lấy 7 tỷ đồng, bà xã Hoàng Kim Khánh không báo công an mà còn cho vay gần 3 tỷ để chuộc lại
Cho mượn xe rồi bị mang đi cầm cố lấy 7 tỷ đồng, bà xã Hoàng Kim Khánh không báo công an mà còn cho vay gần 3 tỷ để chuộc lại Vợ Đức Tiến kiện mẹ chồng, tranh chấp nhà 14 tỷ đồng ở Thủ Đức: Tung clip được cho là bằng chứng
Vợ Đức Tiến kiện mẹ chồng, tranh chấp nhà 14 tỷ đồng ở Thủ Đức: Tung clip được cho là bằng chứng Hoà Minzy ứng xử 10 điểm khi sản phẩm Bắc Bling đạt 100 triệu view bị chê "nhảm nhí hổ lốn"
Hoà Minzy ứng xử 10 điểm khi sản phẩm Bắc Bling đạt 100 triệu view bị chê "nhảm nhí hổ lốn" Vợ ngất lịm, tử vong khi đưa tang chồng
Vợ ngất lịm, tử vong khi đưa tang chồng Xin nghỉ phép để chuẩn bị cho đám cưới không được, nữ nhân viên ngân hàng Big4 Trung Quốc nhảy lầu tự tử
Xin nghỉ phép để chuẩn bị cho đám cưới không được, nữ nhân viên ngân hàng Big4 Trung Quốc nhảy lầu tự tử Nghẹt thở: Người đàn ông nhảy qua lối đi bị gãy ở tầng 50 để tìm kiếm vợ con trong trận động đất tại Bangkok
Nghẹt thở: Người đàn ông nhảy qua lối đi bị gãy ở tầng 50 để tìm kiếm vợ con trong trận động đất tại Bangkok Diễn viên Việt Anh khác lạ sau thẩm mỹ, ca sĩ Quang Lê vui vì giảm 20kg
Diễn viên Việt Anh khác lạ sau thẩm mỹ, ca sĩ Quang Lê vui vì giảm 20kg Kim Soo Hyun "tống cổ" viện G khỏi buổi họp báo chiều nay
Kim Soo Hyun "tống cổ" viện G khỏi buổi họp báo chiều nay
 Kim Soo Hyun tố gia đình Kim Sae Ron ngụy tạo tin nhắn, tuyên bố khởi kiện 209 tỷ giữa họp báo
Kim Soo Hyun tố gia đình Kim Sae Ron ngụy tạo tin nhắn, tuyên bố khởi kiện 209 tỷ giữa họp báo