FDA Mỹ khuyến cáo không lấy dịch họng để xét nghiệm kháng nguyên tại nhà
Cơ quan quản lý dược phẩm và thực phẩm (FDA) của Mỹ khuyến cáo người dân không lấy dịch họng thay dịch tỵ hầu khi làm xét nghiệm kháng nguyên sàng lọc COVID-19 tại nhà.
Khuyến cáo trên được đưa ra sau khi có một số nghiên cứu sơ bộ và báo cáo cho rằng dịch họng có thể cho kết quả chính xác hơn dịch tỵ hầu trong xét nghiệm phát hiện biến thể Omicron.

Nhân viên y tế lấy mẫu xét nghiệm COVID-19 cho người dân tại Los Angeles, bang California, Mỹ ngày 10/1/2022. Ảnh: THX/TTXVN
Trong các tuyên bố đăng trên Twitter và truyền thông, FDA khẳng định hiện không có dữ liệu toàn diện nào cho thấy xét nghiệm dịch họng là phương pháp “chính xác hoặc thích hợp”.
Video đang HOT
Theo một nghiên cứu sơ bộ đăng ngày 10/1, các sinh phẩm xét nghiệm nhanh có thể phát hiện chính xác biến thể Omicron nếu làm theo đúng hướng dẫn của nhà sản xuất. Do đó, giới chuyên gia khuyến nghị người dân tuân thủ hướng dẫn sử dụng các sinh phẩm xét nghiệm nhanh và phải lấy dịch tỵ hầu để xét nghiệm, trong khi các nhà khoa học và các nhà sản xuất xét nghiệm thu thập thêm dữ liệu về các phương pháp xét nghiệm khác nhau.
Trong những tuần gần đây, nhu cầu xét nghiệm nhanh sàng lọc COVID-19 tại Mỹ tăng rất cao. Không giống như các xét nghiệm PCR có độ chính xác cao nhưng vài ngày sau mới có kết quả, người dân có thể mua các sinh phẩm xét nghiệm nhanh tại các cửa hàng dược để tự xét nghiệm tại nhà, kết quả xét nghiệm có sau từ 10-15 phút.
Tuy nhiên, các nhà khoa học cho rằng các sinh phẩm xét nghiệm nhanh tiện lợi nhưng kèm theo nhiều vấn đề, như kết quả xét nghiệm kém chính xác, đặc biệt là trong giai đoạn đầu của bệnh hoặc với những người mắc bệnh không biểu hiện triệu chứng.
Trong làn sóng lây nhiễm Omicron tại Mỹ, một số chuyên gia, trong đó có Tiến sĩ Anthony Fauci, cho rằng các xét nghiệm nhanh có thể cho kết quả thiếu chính xác đối với Omicron. Trong thông báo đưa ra ngày 7/1, FDA cảnh báo người dân Mỹ cần tuân thủ hướng dẫn trên sinh phẩm xét nghiệm nhanh, phải lấy dịch tỵ hầu, không lấy dịch họng. FDA khẳng định hiện FDA “không có bất kỳ dữ liệu nào cho thấy xét nghiệm dịch họng là phương pháp xét nghiệm chính xác hoặc thích hợp đối với xét nghiệm tại nhà”.
Bên cạnh đó, FDA lưu ý việc sử dụng sinh phẩm xét nghiệm nhanh tại nhà theo đúng hướng dẫn có thể “tránh kết quả sai lệnh hoặc tổn thương”. Theo cơ quan trên, việc tự lấy dịch họng có thể phức tạp hơn dịch tỵ hầu và nếu thao tác không đúng có thể gây hại cho bệnh nhân.
Mỹ cấp phép thuốc dự phòng lây nhiễm HIV dạng tiêm đầu tiên
Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) vừa phê duyệt loại thuốc dự phòng lây nhiễm HIV dạng tiêm đầu tiên, đem lại giải pháp thay thế cho thuốc viên.
Loại thuốc mới mang tên Apretude được tiêm cho bệnh nhân hai tháng một lần, trong khi những thuốc viên ngăn ngừa lây nhiễm HIV đang lưu hành trên thị trường hiện nay cần phải uống đều đặn hàng ngày.
Các quan chức y tế cảnh báo rằng thuốc uống hàng ngày có thể là chế độ điều trị mà một số người khó tuân thủ. Do vậy, việc tiêm thuốc trở thành một lựa chọn khả thi hơn đối với những người có nguy cơ.
FDA đã đưa ra quyết định trên sau khi hai thử nghiệm cho thấy, đối với 69% đàn ông có giới tính bình thường và phụ nữ chuyển giới có quan hệ tình dục với đàn ông, cũng như 90% phụ nữ có giới tình bình thường, thì Apretude có hiệu quả hơn trong việc giảm nguy cơ nhiễm HIV so với thuốc uống hàng ngày.
Cuối cùng, FDA phát hiện rằng loại thuốc tiêm này có hiệu quả hơn 66% trong việc ngăn ngừa lây nhiễm HIV so với một liều thuốc viên Truvada hàng ngày.
Hai thử nghiệm thuốc Apredute được tiến hành tại 13 quốc gia, bao gồm một nghiên cứu đối với 4.500 đàn ông và phụ nữ chuyển giới không nhiễm HIV có quan hệ tình dục với đàn ông, trong khi nghiên cứu còn lại tập trung vào trên 3.000 phụ nữ giới tính bình thường có nguy cơ nhiễm HIV.
Là một dạng thuốc cabotegravir của hãng dược phẩm GlaxoSmithKline, Apretude được cấp phép sử dụng cho người lớn và thanh thiếu niên có nguy cơ ở Mỹ. Ban đầu nó được tiêm hai liều, cách nhau một tháng, sau đó tiêm hai tháng một lần. Thuốc chỉ được sử dụng cho những đối tượng có kết quả xét nghiệm HIV âm tính.
Vì sao phải chia nhóm tuổi thử nghiệm vắc xin? 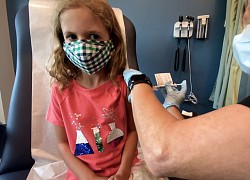 Hôm 7-10, Hãng Pfizer-BioNTech nộp đơn đề nghị FDA Mỹ cấp phép khẩn cấp cho vắc xin COVID-19 dành cho lứa tuổi từ 5-11, trong khi đang nghiên cứu vắc xin cho nhóm dưới 5 tuổi. Vì sao phải chia nhiều nhóm như vậy? Em Lydia Melo, 7 tuổi, được tiêm liều 10 microgram vắc xin COVID-19 của Pfizer-BioNTech trong một thử nghiệm...
Hôm 7-10, Hãng Pfizer-BioNTech nộp đơn đề nghị FDA Mỹ cấp phép khẩn cấp cho vắc xin COVID-19 dành cho lứa tuổi từ 5-11, trong khi đang nghiên cứu vắc xin cho nhóm dưới 5 tuổi. Vì sao phải chia nhiều nhóm như vậy? Em Lydia Melo, 7 tuổi, được tiêm liều 10 microgram vắc xin COVID-19 của Pfizer-BioNTech trong một thử nghiệm...
 Đòn giáng của ông Trump vào Ukraine trước ngưỡng cửa đàm phán với Nga09:07
Đòn giáng của ông Trump vào Ukraine trước ngưỡng cửa đàm phán với Nga09:07 Lãnh đạo Mỹ - Ukraine khẩu chiến kịch liệt08:41
Lãnh đạo Mỹ - Ukraine khẩu chiến kịch liệt08:41 'Ông Trump rất thất vọng về ông Zelensky, muốn Ukraine thỏa thuận khoáng sản 500 tỉ USD'09:08
'Ông Trump rất thất vọng về ông Zelensky, muốn Ukraine thỏa thuận khoáng sản 500 tỉ USD'09:08 Ông Trump bất ngờ nặng lời về ông Zelensky, nhiều bên bị sốc08:41
Ông Trump bất ngờ nặng lời về ông Zelensky, nhiều bên bị sốc08:41 Campuchia bàn biện pháp giải quyết tác động từ dự án kênh đào Phù Nam-Techo09:30
Campuchia bàn biện pháp giải quyết tác động từ dự án kênh đào Phù Nam-Techo09:30 Tổng thống Zelensky nói về khoáng sản của Ukraine sau phát biểu của ông Trump08:29
Tổng thống Zelensky nói về khoáng sản của Ukraine sau phát biểu của ông Trump08:29 Sau khi được thả từ Gaza, 5 con tin người Thái Lan nhận được tiền, lương tháng08:59
Sau khi được thả từ Gaza, 5 con tin người Thái Lan nhận được tiền, lương tháng08:59 Sau luật cấm thịt chó, hàng trăm trang trại nuôi thịt ở Hàn Quốc đóng cửa02:22
Sau luật cấm thịt chó, hàng trăm trang trại nuôi thịt ở Hàn Quốc đóng cửa02:22 Trung Quốc phát hiện được chiến đấu cơ tàng hình F-35 từ xa 2.000 km?03:50
Trung Quốc phát hiện được chiến đấu cơ tàng hình F-35 từ xa 2.000 km?03:50 Căng thẳng Gaza dâng cao trở lại09:18
Căng thẳng Gaza dâng cao trở lại09:18 Tổng thống Putin lần đầu nói chuyện với lãnh đạo mới của Syria09:12
Tổng thống Putin lần đầu nói chuyện với lãnh đạo mới của Syria09:12Tiêu điểm
Tin đang nóng
Tin mới nhất

Tiền tuyến Ukraine dưới áp lực từ hậu trường

Trung Quốc nêu lập trường sau cuộc đối thoại Mỹ-Nga về xung đột Ukraine

Sư sãi Campuchia muốn tù nhân đổi màu áo để tránh gây nhầm lẫn

Ông Elon Musk gây sốt khi cầm cưa 'xử lý bộ máy quan liêu' trên sân khấu

Cảnh sát Philippines đột kích công ty đánh bạc trực tuyến, bắt 5 chủ người Trung Quốc

Liên kết tăng thế, thêm lực

Một công nhân bị thương khi ngọn lửa bùng cháy dữ dội tại trung tâm tái chế

Đến Hokuriku khám phá nghề thủ công truyền thống cổ xưa của Nhật Bản

Đặc sắc Lễ hội Voi Sayaboury

'Ông Trump rất thất vọng về ông Zelensky, muốn Ukraine thỏa thuận khoáng sản 500 tỉ USD'

Châu Âu vẫn chia rẽ về giải pháp hòa bình cho Ukraine

Nhân vật gây tranh luận nảy lửa chính thức trở thành giám đốc FBI
Có thể bạn quan tâm

Hoa hậu Đỗ Hà tuyên bố ngừng hợp tác với Sen Vàng, phản ứng của vợ chồng "bà trùm hoa hậu" gây chú ý
Sao việt
7 giờ trước
Những người nên uống nước chè xanh thường xuyên
Sức khỏe
7 giờ trước
10 cách giúp thu nhỏ lỗ chân lông
Làm đẹp
7 giờ trước
Chị dâu đem giỏ bánh qua tặng các cháu, khui ra, tôi tá hỏa khi thấy túi đỏ bên trong cùng lời nhắn đầy khó hiểu
Góc tâm tình
7 giờ trước
Hai món bánh xèo làm từ rau cần nước vừa nhẹ bụng, ngon miệng lại giúp giảm cân hiệu quả
Ẩm thực
7 giờ trước
Nỗi oan ức của Song Hye Kyo
Hậu trường phim
8 giờ trước
Diễn viên Hồ Ca phản ứng trước tin bị ung thư phổi, gần qua đời
Sao châu á
14 giờ trước
'Nổ' quen lãnh đạo công an để lừa đảo
Pháp luật
14 giờ trước
'Cha tôi người ở lại' tập 4: Cả nhà sốc khi ông Bình say xỉn, bất ngờ nổi nóng
Phim việt
14 giờ trước
Tây Ninh: Vi phạm nồng độ cồn, không bằng lái xe, gây tai nạn chết người
Tin nổi bật
14 giờ trước
 Hàn Quốc cấp phép sử dụng vaccine của Novavax (Mỹ)
Hàn Quốc cấp phép sử dụng vaccine của Novavax (Mỹ) Thách thức của châu Âu trên đường coi COVID-19 là bệnh đặc hữu
Thách thức của châu Âu trên đường coi COVID-19 là bệnh đặc hữu
 312 sinh viên Hải Dương đang hỗ trợ TP.HCM chống dịch
312 sinh viên Hải Dương đang hỗ trợ TP.HCM chống dịch Lầu Năm Góc 'chấn động' khi Tổng thống Trump sa thải chỉ huy cao nhất của quân đội Mỹ
Lầu Năm Góc 'chấn động' khi Tổng thống Trump sa thải chỉ huy cao nhất của quân đội Mỹ Tác động của việc chấm dứt xung đột Nga - Ukraine với kinh tế châu Âu
Tác động của việc chấm dứt xung đột Nga - Ukraine với kinh tế châu Âu Ông Elon Musk tuyên bố Ukraine đã đi quá xa trong xung đột với Nga
Ông Elon Musk tuyên bố Ukraine đã đi quá xa trong xung đột với Nga
 Mỹ có thể cắt quyền truy cập Starlink, gây áp lực với Ukraine về thỏa thuận khoáng sản
Mỹ có thể cắt quyền truy cập Starlink, gây áp lực với Ukraine về thỏa thuận khoáng sản

 Bố của Vũ Cát Tường qua đời
Bố của Vũ Cát Tường qua đời Xót xa trước tin nhắn cuối cùng bố đẻ gửi cho Vũ Cát Tường trước khi mất vì ung thư
Xót xa trước tin nhắn cuối cùng bố đẻ gửi cho Vũ Cát Tường trước khi mất vì ung thư Uông Tiểu Phi đã đón 2 con về Bắc Kinh, mẹ Từ Hy Viên quyết đòi rể cũ trả món nợ 900 tỷ đồng?
Uông Tiểu Phi đã đón 2 con về Bắc Kinh, mẹ Từ Hy Viên quyết đòi rể cũ trả món nợ 900 tỷ đồng? 1 câu nói đang viral khắp MXH Việt vì ai nghe cũng như bị xoáy trúng tim đen
1 câu nói đang viral khắp MXH Việt vì ai nghe cũng như bị xoáy trúng tim đen 1 Hoa hậu Việt Nam có động thái y hệt Phương Nhi: Rục rịch kết hôn với thiếu gia?
1 Hoa hậu Việt Nam có động thái y hệt Phương Nhi: Rục rịch kết hôn với thiếu gia? Trịnh Sảng bị tố làm nhân tình của đại gia lừa đảo ở Mỹ, lộ điều khoản "bán thân" gây sốc?
Trịnh Sảng bị tố làm nhân tình của đại gia lừa đảo ở Mỹ, lộ điều khoản "bán thân" gây sốc? Ca sĩ Hoài Lâm yêu mặn nồng bạn gái, tình trẻ của NSND Việt Anh sắc sảo
Ca sĩ Hoài Lâm yêu mặn nồng bạn gái, tình trẻ của NSND Việt Anh sắc sảo Kháng nghị giám đốc thẩm vụ 'ủy quyền tách thửa, bị bán đất lưu giữ mồ mả'
Kháng nghị giám đốc thẩm vụ 'ủy quyền tách thửa, bị bán đất lưu giữ mồ mả'
 Cả mạng xã hội liên tục nhắc tên Phạm Thoại và mẹ bé Bắp: Chuyện gì đang xảy ra?
Cả mạng xã hội liên tục nhắc tên Phạm Thoại và mẹ bé Bắp: Chuyện gì đang xảy ra? Chở thi thể nữ sinh bị tai nạn tử vong về nhà, xe cấp cứu gặp nạn
Chở thi thể nữ sinh bị tai nạn tử vong về nhà, xe cấp cứu gặp nạn Nhân chứng kể lại giây phút kinh hoàng vụ tai nạn 6 người chết ở Sơn La
Nhân chứng kể lại giây phút kinh hoàng vụ tai nạn 6 người chết ở Sơn La Xác định kẻ sát hại 2 mẹ con tại nhà riêng ở Bình Dương
Xác định kẻ sát hại 2 mẹ con tại nhà riêng ở Bình Dương Công an cảnh báo mối nguy hại từ "chiếc váy hồng 2 dây" hot nhất mạng xã hội
Công an cảnh báo mối nguy hại từ "chiếc váy hồng 2 dây" hot nhất mạng xã hội Công bố thời khắc hấp hối của Từ Hy Viên, minh tinh nắm chặt tay 1 người không buông
Công bố thời khắc hấp hối của Từ Hy Viên, minh tinh nắm chặt tay 1 người không buông
 Nhân chứng kể khoảnh khắc phát hiện 2 mẹ con bị sát hại ở Bình Dương
Nhân chứng kể khoảnh khắc phát hiện 2 mẹ con bị sát hại ở Bình Dương Chuyện gì đã xảy ra khiến vợ Vũ Cát Tường cư xử lạ sau lễ thành đôi?
Chuyện gì đã xảy ra khiến vợ Vũ Cát Tường cư xử lạ sau lễ thành đôi?