Đại diện Bộ Y tế: Kiến nghị cấp phép vắc xin Nano Covax là ‘nóng vội, chưa đầy đủ dữ liệu khoa học’
Đại diện Bộ Y tế khẳng định một loại vắc xin muốn được cấp phép sử dụng phải đảm bảo 3 yếu tố: An toàn, sinh miễn dịch và hiệu lực bảo vệ. Và vắc xin Nano Covax nghiên cứu dù có tính sinh miễn dịch tốt nhưng chưa đủ cấp phép khẩn cấp.
Ông Nguyễn Ngô Quang – phó cục trưởng Cục Khoa học công nghệ và đào tạo (Bộ Y tế) – Ảnh: HOÀNG LỘC
Trả lời Tuổi Trẻ Online sau kiến nghị của Công ty cổ phần công nghệ sinh học dược Nanogen (Nanogen, Khu công nghệ cao TP.HCM) về việc việc xin cấp phép khẩn cấp cho vắc xin Nano Covax, ông Nguyễn Ngô Quang – phó cục trưởng Cục Khoa học công nghệ và đào tạo (Bộ Y tế) khẳng định:
“Trong bối cảnh hiện nay, việc cấp phép khẩn cấp cho một loại vắc xin phòng COVID-19 là điều cần thiết. Tuy nhiên tất cả phải trên nguyên tắc đầy đủ các dữ liệu về mặt khoa học, phải chứng minh và trả lời được 3 câu hỏi lớn là: Có an toàn không, có sinh miễn dịch không và điều đặc biệt quan trọng đó là có hiệu lực bảo vệ không”.
* Như vậy với vắc xin Nano Covax, ông đánh giá đã đáp ứng các dữ liệu cần thiết chưa?
- Tôi không nói là vắc xin này không an toàn, không đảm bảo tính sinh miễn dịch và không có hiệu lực bảo vệ. Nhưng hiện đang còn trong quá trình nghiên cứu, thử nghiệm, chưa xong và chưa có dữ liệu gì cả.
Kiến nghị này rất khó được chấp thuận bởi đây thuộc thẩm quyền chuyên môn của Bộ Y tế. Và để quyết định có cấp phép khẩn cấp hay không, Bộ Y tế cần có các dữ liệu khoa học.
Video đang HOT
Vắc xin của Nanogen sản xuất trong giai đoạn thử nghiệm lâm sàng – Ảnh: HOÀNG LỘC
* Khi đưa ra kiến nghị này, Nanogen có nêu kết quả thử nghiệm lâm sàng, khả năng sinh miễn dịch của vắc xin Nano Covax đạt 99,4%. Nếu so sánh với các loại vắc xin khác trên thế giới là không hề thua kém và có phần cao hơn…
- Đó chỉ mới là tính sinh miễn dịch. Nhưng miễn dịch này liệu có giảm được tỉ lệ mắc COVID-19, hoặc mắc rồi có giảm nhẹ tình trạng bệnh hay không thì chưa có kết quả.
Hiện nay vắc xin Nano Covax đã đi qua giai đoạn 2 của cuộc thử nghiệm và theo đánh giá có sinh miễn dịch rất tốt. Tuy nhiên việc nghiên cứu mới chỉ ở cỡ mẫu vừa phải (mấy trăm người), chưa “nói lên điều gì”, trong khi với vắc xin đòi hỏi cỡ mẫu phải vào chục ngàn người.
Tương tự giai đoạn 3 cũng mới chỉ tiêm xong mũi 1 cho 1.000 người và cỡ mẫu này vẫn chưa đủ để đánh giá. Trong khi theo kế hoạch cỡ mẫu giai đoạn 3 thử nghiệm trên 13.000 người.
Ngoài ra sau tiêm thử nghiệm mũi 2 (sau 28 ngày), cơ quan chuyên môn cần phải tiếp tục đánh giá sau 36, 45, 56 ngày sau tiêm. Trên cơ sở đó mới đủ tiêu chuẩn đánh giá tính sinh miễn dịch và hiệu lực bảo vệ ra sao. Như vậy ít nhất phải sau 2 tháng và thử nghiệm trên cỡ mẫu này mới có thể đánh giá.
* Vậy về kiến nghị này của Nanogen, quan điểm của ông như thế nào?
- Quan điểm của Bộ Y tế cũng như cá nhân tôi là hoàn toàn ủng hộ cho sự nghiên cứu phát triển vắc xin trong nước để chủ động được nguồn vắc xin của Việt Nam. Đây là chỉ đạo rất đúng của Chính phủ.
Nhưng trước khi một loại vắc xin đưa ra tiêm rộng rãi cho người dân về nguyên tắc Bộ Y tế phải có các dữ liệu về an toàn, tính sinh miễn dịch và đặc biệt là hiệu lực bảo vệ. Bởi vì vấn đề này sau này Bộ Y tế và tôi phải giải trình với xã hội, với người dân: “vắc xin này có hiệu quả hay không” và “căn cứ vào đâu để nói là hiệu quả” và “tại sao đồng ý cấp phép”.
Mục tiêu của ngành y tế là bảo vệ sức khỏe người dân. Do đó với trách nhiệm là cơ quan phát triển công nghệ và cơ quan quản lý phát triển các sản phẩm mới, đặc biệt vắc xin, chúng tôi không thể nói loại vắc xin này tốt lắm để cấp phép khi chưa đủ các dữ liệu khoa học cần thiết.
Ông Hồ Nhân – tổng giám đốc Công ty Nanogen trình bày với Hội đồng đạo đức của Bộ Y tế trong giai đoạn thử nghiệm giai đoạn 2 – Ảnh: HOÀNG LỘC
* Vậy trước đó kiến nghị này Bộ Y tế có được biết và thông qua trước không, thưa ông?
- Là người theo sát phản biện, góp ý và hướng dẫn cho công ty Nanogen trong suốt quá trình nghiên cứu nhưng tôi hoàn toàn không được biết về kiến nghị này.
Nhưng đây là quyền của doanh nghiệp, nếu họ thấy cần thiết thì kiến nghị còn cho phép hay không, cơ quan quản lý phải căn cứ vào các quy định.
Tôi cho rằng kiến nghị của Nanogen là quá sớm và nóng vội khi chưa đầy đủ các dữ liệu về mặt khoa học.
Chủ tịch Quốc hội yêu cầu đẩy nhanh tiến độ nghiên cứu vắc xin Nano Covax
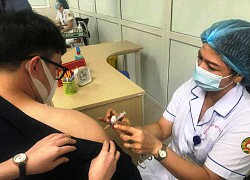
Chiều nay 10-6, khoảng 20 người đầu tiên trong số dự kiến 13.000 người tham gia thử nghiệm lâm sàng giai đoạn 3 vắc xin ngừa COVID-19 nội địa có tên Nano Covax đã được tiêm tại Học viện Quân y, Hà Nội.
Khám sàng lọc trước khi thử nghiệm lâm sàng giai đoạn 3 tại Học viện Quân y - Ảnh: THÚY ANH
Chủ tịch Quốc hội Vương Đình Huệ cùng 5 bộ trưởng, trong đó có bộ trưởng Bộ Quốc phòng, Bộ Y tế, Bộ Tài chính, Bộ Kế hoạch và đầu tư đã đến thăm những người tình nguyện tiêm thử nghiệm đầu tiên của giai đoạn 3 và thăm các nhà khoa học, y bác sĩ tham gia nghiên cứu.
Theo thông tin của Tuổi Trẻ Online , dự kiến trong ngày mai 11-6, nhóm sẽ tiêm sớm cho 1.000 người thử nghiệm đầu tiên trong 13.000 tham gia thử nghiệm giai đoạn 3.
Số lượng tiêm mỗi ngày sau sẽ đến mức tối đa khả năng của đơn vị triển khai thử lâm sàng, sớm hoàn thành mốc 1.000 người đầu tiên để theo dõi, đánh giá kết quả, hoàn thiện bộ hồ sơ dữ liệu thử nghiệm lâm sàng giai đoạn 3, tiến tới nộp hồ sơ đăng ký lưu hành vắc xin này (dự kiến vào quý 4 năm nay).
12.000 người tình nguyện cùng tham gia giai đoạn 3 sẽ tiếp tục được tiêm và theo dõi trong thời gian tới, tại các điểm tiêm ở Hà Nội, TP.HCM, Tiền Giang, Hưng Yên...
Hiện riêng tại Học viện Quân y, một trong những đơn vị triển khai đợt thử nghiệm này, đã có trên 600 người được khám sàng lọc, đủ điều kiện tiêm và trên 7.000 người chờ khám sàng lọc để tham gia thử nghiệm.
Vắc xin Nano Covax là 1 trong 3 vắc xin ngừa COVID-19 nội được phát triển trong nước từ giữa năm 2020, đến nay đây là vắc xin có tiến độ nghiên cứu nhanh nhất.
Được phát triển trên nền công nghệ tái tổ hợp protein, ở giai đoạn 1 và 2 vắc xin được sử dụng cho trên 600 người ở 3 mức liều 25, 50 và 75 mcg, người cao tuổi nhất tham gia tiêm ngừa là 77 tuổi, kết quả cho thấy vắc xin đảm bảo yêu cầu an toàn và tính sinh miễn dịch.
Ở giai đoạn 3 này, vắc xin sẽ được tiêm trên 13.000 người, nhưng chia làm 2 mốc: 1.000 người đầu tiên để tiến tới đủ đăng ký lưu hành vắc xin theo hình thức khẩn cấp, và 12.000 người kế tiếp, cùng tiêm mức liều 25 mcg, và đánh giá 3 chỉ số tính an toàn, tính sinh miễn dịch và hiệu quả bảo vệ của vắc xin.
Nguồn tin của Tuổi Trẻ Online cũng cho biết nếu được phê duyệt, nhà sản xuất có thể sản xuất 50 triệu liều vắc xin Nano Covax năm 2021 và 100 triệu liều năm 2022, đáp ứng một phần đáng kể nhu cầu sử dụng trong nước.
Vắc-xin do Việt Nam sản xuất có thể tiêm cho nhóm nguy cơ cao vào tháng 5  Sáng 19/2, Hội đồng đạo đức trong nghiên cứu y sinh học của Bộ Y tế có cuộc họp cuối trước khi đưa ra quyết định chấp thuận cho thử nghiệm lâm sàng giai đoạn 2 vắc-xin Nanocovax do Công ty cổ phần Sinh học dược Nanogen nghiên cứu, sản xuất. Ông Nguyễn Ngô Quang - Phó cục trưởng Cục Khoa học công...
Sáng 19/2, Hội đồng đạo đức trong nghiên cứu y sinh học của Bộ Y tế có cuộc họp cuối trước khi đưa ra quyết định chấp thuận cho thử nghiệm lâm sàng giai đoạn 2 vắc-xin Nanocovax do Công ty cổ phần Sinh học dược Nanogen nghiên cứu, sản xuất. Ông Nguyễn Ngô Quang - Phó cục trưởng Cục Khoa học công...
 Sự thật ngỡ ngàng người đàn ông chui qua cửa kính taxi kêu cứu trên cao tốc00:46
Sự thật ngỡ ngàng người đàn ông chui qua cửa kính taxi kêu cứu trên cao tốc00:46 Quán bún Hà Nội xin lỗi vụ bán 1,2 triệu đồng 3 bát bún riêu ngày Tết, nói chỉ là 'hiểu lầm'09:39
Quán bún Hà Nội xin lỗi vụ bán 1,2 triệu đồng 3 bát bún riêu ngày Tết, nói chỉ là 'hiểu lầm'09:39 Vụ xe ôtô lao xuống mương 7 người tử vong: Công an công bố nguyên nhân ban đầu14:39
Vụ xe ôtô lao xuống mương 7 người tử vong: Công an công bố nguyên nhân ban đầu14:39 11 'quái xế' chạy vào cao tốc Nghi Sơn - Diễn Châu bị phạt 78 triệu đồng501:27
11 'quái xế' chạy vào cao tốc Nghi Sơn - Diễn Châu bị phạt 78 triệu đồng501:27 Tiết lộ về nữ doanh nhân ở Hải Dương nhảy xuống hồ cứu 3 cháu bé02:38
Tiết lộ về nữ doanh nhân ở Hải Dương nhảy xuống hồ cứu 3 cháu bé02:38 CSGT hú còi mở đường cho xe chở người bị điện giật nguy kịch đi cấp cứu01:10
CSGT hú còi mở đường cho xe chở người bị điện giật nguy kịch đi cấp cứu01:10 Thông tin về ô tô 'tự di chuyển' ở sân bay Tân Sơn Nhất09:00
Thông tin về ô tô 'tự di chuyển' ở sân bay Tân Sơn Nhất09:00 Lọ Lem diện áo nhỏ xíu, nhún nhảy hút triệu view, còn được bố ruột làm điều này!03:16
Lọ Lem diện áo nhỏ xíu, nhún nhảy hút triệu view, còn được bố ruột làm điều này!03:16 Mới sinh con 3 tháng, người mẹ trẻ không có đối thủ trên sới vật02:34
Mới sinh con 3 tháng, người mẹ trẻ không có đối thủ trên sới vật02:34 Đi ngược chiều trên cao tốc, nữ tài xế bị phạt 19 triệu đồng01:30
Đi ngược chiều trên cao tốc, nữ tài xế bị phạt 19 triệu đồng01:30 Drama Bộ Tứ Báo Thủ nghi thuê 2 tỷ dàn dựng, người tiết lộ xuất hiện công khai?03:15
Drama Bộ Tứ Báo Thủ nghi thuê 2 tỷ dàn dựng, người tiết lộ xuất hiện công khai?03:15Tiêu điểm
Tin đang nóng
Tin mới nhất

Nữ sinh Sơn La 17 tuổi mất tích: Gia đình nhận tin con gái ở Cần Thơ

Lật xe khách tại Phú Yên khiến 3 người chết, nhiều người bị thương

Người phụ nữ tìm được gia đình sau 32 năm bị lừa bán sang Trung Quốc

Bốn trận động đất liên tiếp trong sáng nay ở Kon Tum

Vụ khe co giãn cao tốc bị bung, nhiều xe nổ lốp: Cục Đường bộ chỉ đạo nóng

Thứ trưởng Bộ Công an: Tội phạm trên không gian mạng là vấn đề nan giải

Tai nạn chết người ở đường sắt tại Đồng Nai, tàu hỏa tê liệt gần một giờ

Vụ nam shipper bị đánh tử vong: Gia đình nhận được cuộc gọi nghi lừa đảo

Lý do căn nhà cháy thiệt hại 50 triệu, chủ trình báo 400 triệu đồng

Tông trực diện vào ô tô bán tải, 2 người đi xe máy tử vong tại chỗ

Bung khe co giãn cao tốc qua Thanh Hóa, nhiều ô tô bị nổ lốp

Học sinh THPT ở Đồng Nai cho bạn vay nặng lãi, cao gấp 12-28 lần lãi ngân hàng
Có thể bạn quan tâm

Chồng rút ruột tiền lì xì của con, làm một việc khiến vợ tức điên
Góc tâm tình
05:52:58 09/02/2025
Trấn Thành hứa hẹn chấn động về phim Tết 2026, để HIEUTHUHAI yêu 1 cái tên khiến ai cũng sốc
Hậu trường phim
23:39:31 08/02/2025
Buổi livestream All-star thử giọng bất ổn nhất Vbiz: Sơn Tùng lạc cả giọng, HIEUTHUHAI đang rap thì líu lưỡi
Nhạc việt
23:19:37 08/02/2025
Nữ chính từng ba lần bị bạn trai lừa tiền, từ chối hẹn hò giám đốc U.40
Tv show
23:05:28 08/02/2025
Những lần mặc gợi cảm gây tranh luận của con gái Quyền Linh
Phong cách sao
22:58:44 08/02/2025
Tiến Linh được đổi lại huy chương 'nhà vô địch' ASEAN Cup sau nhầm lẫn
Sao thể thao
22:58:04 08/02/2025
Kaity Nguyễn: "Không yêu là mình đang mất đi một món ngon rồi"
Sao việt
22:54:59 08/02/2025
Ukraine đổi chiến lược trong xung đột với Nga giữa lúc Tổng thống Trump thúc đẩy ngừng bắn
Thế giới
22:16:08 08/02/2025
Taylor Swift cho bạn thân Blake Lively "ra rìa" giữa scandal ồn ào thế giới?
Sao âu mỹ
21:41:11 08/02/2025
Cặp vợ chồng nhận nuôi một chú mèo, 8 năm sau, phim chụp X-quang tiết lộ sự thật sốc
Netizen
21:13:24 08/02/2025
 Tổng cục Thuế nói gì về quy định thu thuế cho thuê nhà?
Tổng cục Thuế nói gì về quy định thu thuế cho thuê nhà? Quảng Bình: Dân “thở phào” khi 6 F1 của 2 lái xe mắc Covid-19 đều âm tính
Quảng Bình: Dân “thở phào” khi 6 F1 của 2 lái xe mắc Covid-19 đều âm tính


 Hoàn tất 1.000 mũi đầu tiên thử nghiệm giai đoạn 3 vắc xin COVID-19 Nano Covax
Hoàn tất 1.000 mũi đầu tiên thử nghiệm giai đoạn 3 vắc xin COVID-19 Nano Covax Bình Thuận kêu gọi những người về từ Gia Lai khai báo y tế
Bình Thuận kêu gọi những người về từ Gia Lai khai báo y tế Bác sĩ Nguyễn Trung Cấp: 'Diễn biến bệnh nhân Covid-19 có vẻ nhanh hơn'
Bác sĩ Nguyễn Trung Cấp: 'Diễn biến bệnh nhân Covid-19 có vẻ nhanh hơn' Khung pháp lý cho thuốc lá thế hệ mới: Cần nghiên cứu kỹ
Khung pháp lý cho thuốc lá thế hệ mới: Cần nghiên cứu kỹ Hành trình của 3 ca Covid-19 mới ở TP Hạ Long
Hành trình của 3 ca Covid-19 mới ở TP Hạ Long 80% ca mắc Covid-19 không có triệu chứng, bệnh viện dễ để lọt ca bệnh
80% ca mắc Covid-19 không có triệu chứng, bệnh viện dễ để lọt ca bệnh Danh tính các nạn nhân tử vong trong xe khách bị lật ở Phú Yên
Danh tính các nạn nhân tử vong trong xe khách bị lật ở Phú Yên Nữ sinh mất tích bí ẩn ở TPHCM được tìm thấy tại Trung Quốc
Nữ sinh mất tích bí ẩn ở TPHCM được tìm thấy tại Trung Quốc Thông tin mới vụ xe tải cán qua người đi xe máy 2 lần trên Quốc lộ 51 ở Đồng Nai
Thông tin mới vụ xe tải cán qua người đi xe máy 2 lần trên Quốc lộ 51 ở Đồng Nai Hành khách trong vụ tai nạn ở Phú Yên: Đi Đà Lạt chụp ảnh cưới thì bị nạn
Hành khách trong vụ tai nạn ở Phú Yên: Đi Đà Lạt chụp ảnh cưới thì bị nạn Danh tính nạn nhân tử vong trong xe khách 54 chỗ bị lật ở Phú Yên
Danh tính nạn nhân tử vong trong xe khách 54 chỗ bị lật ở Phú Yên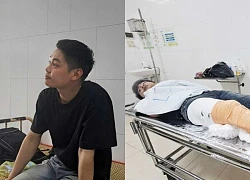 Kinh hoàng vụ lật xe khách tại Phú Yên và lời kể của nạn nhân
Kinh hoàng vụ lật xe khách tại Phú Yên và lời kể của nạn nhân Hàng chục con trâu của người dân chết trong rừng
Hàng chục con trâu của người dân chết trong rừng Hai chị em uống nhầm thuốc diệt chuột: Bé trai đã tử vong
Hai chị em uống nhầm thuốc diệt chuột: Bé trai đã tử vong Tài xế xe ôm bị thương nặng sau tai nạn giao thông liên hoàn tại Cầu Giấy, Hà Nội
Tài xế xe ôm bị thương nặng sau tai nạn giao thông liên hoàn tại Cầu Giấy, Hà Nội Thiều Bảo Trâm đăng đàn ẩn ý, 1 chi tiết dự sắp bùng drama giữa lúc tình cũ nghi hẹn hò Hoa hậu?
Thiều Bảo Trâm đăng đàn ẩn ý, 1 chi tiết dự sắp bùng drama giữa lúc tình cũ nghi hẹn hò Hoa hậu?
 Đạo diễn 'vượt mặt' cả Trấn Thành và Thu Trang là ai?
Đạo diễn 'vượt mặt' cả Trấn Thành và Thu Trang là ai?
 Tết đầu làm dâu, mẹ chồng giục tôi về ngoại từ rất sớm, chưa kịp mừng thì chiếc laptop để quên đã vạch trần bí mật của nhà chồng
Tết đầu làm dâu, mẹ chồng giục tôi về ngoại từ rất sớm, chưa kịp mừng thì chiếc laptop để quên đã vạch trần bí mật của nhà chồng Vợ chồng tôi bị đuổi khỏi nhà ngoại vì đứa cháu ngây ngô khoe một chuyện nhỏ xíu từ hôm mùng 1 Tết
Vợ chồng tôi bị đuổi khỏi nhà ngoại vì đứa cháu ngây ngô khoe một chuyện nhỏ xíu từ hôm mùng 1 Tết Bạn gái gây tranh cãi vì tấm ảnh chụp trong sinh nhật của Ronaldo, bị chê "bất lịch sự" với mẹ chồng tương lai
Bạn gái gây tranh cãi vì tấm ảnh chụp trong sinh nhật của Ronaldo, bị chê "bất lịch sự" với mẹ chồng tương lai Bức ảnh làm lộ chuyện 2 con Từ Hy Viên bị bỏ bê nghiêm trọng sau khi đột ngột mất mẹ
Bức ảnh làm lộ chuyện 2 con Từ Hy Viên bị bỏ bê nghiêm trọng sau khi đột ngột mất mẹ Châu Du Dân 2 lần đưa tang tình cũ: Trầm cảm vì mất Hứa Vỹ Luân, 18 năm sau bi kịch lặp lại với Từ Hy Viên
Châu Du Dân 2 lần đưa tang tình cũ: Trầm cảm vì mất Hứa Vỹ Luân, 18 năm sau bi kịch lặp lại với Từ Hy Viên Ca sĩ Lynda Trang Đài sau khi bị bắt vì ăn trộm: Có động thái lạ trên MXH, dàn sao hé lộ tình trạng bất ổn
Ca sĩ Lynda Trang Đài sau khi bị bắt vì ăn trộm: Có động thái lạ trên MXH, dàn sao hé lộ tình trạng bất ổn Chấn động: Bằng chứng "nút thắt" trong vụ án của Tangmo Nida lộ diện sau 3 năm, cuộc điều tra liệu có bước ngoặt?
Chấn động: Bằng chứng "nút thắt" trong vụ án của Tangmo Nida lộ diện sau 3 năm, cuộc điều tra liệu có bước ngoặt? Nóng: Tro cốt Từ Hy Viên bị phản đối đặt tại nhà, gia đình phải đưa ra quyết định an táng gây xót xa
Nóng: Tro cốt Từ Hy Viên bị phản đối đặt tại nhà, gia đình phải đưa ra quyết định an táng gây xót xa Supachok rớt giá thảm hại hậu ASEAN Cup 2024
Supachok rớt giá thảm hại hậu ASEAN Cup 2024 Đòn trừng phạt chồng cũ Từ Hy Viên và mẹ chồng cũ sau trò lố lợi dụng cái chết của minh tinh
Đòn trừng phạt chồng cũ Từ Hy Viên và mẹ chồng cũ sau trò lố lợi dụng cái chết của minh tinh Đoạn văn 85 chữ miêu tả ông nội của học sinh tiểu học khiến cả cõi mạng cười bò, "nạn nhân" đọc xong ho nguyên 1 bản giao hưởng
Đoạn văn 85 chữ miêu tả ông nội của học sinh tiểu học khiến cả cõi mạng cười bò, "nạn nhân" đọc xong ho nguyên 1 bản giao hưởng Bị truy đuổi, tên trộm bơi qua sông nhưng không thoát nên dùng dao tự sát
Bị truy đuổi, tên trộm bơi qua sông nhưng không thoát nên dùng dao tự sát