22 loại thuốc ngừng bán tại Việt Nam
Cục Quản lý Dược đã quyết định rút giấy đăng ký lưu hành 22 loại thuốc khỏi danh mục các thuốc được cấp giấy đăng ký lưu hành tại Việt Nam.
Ngày 21/6 vừa qua, ông Đỗ Văn Đông, Phó Cục trưởng Cục Quản lý dược (Bộ Y tế) đã ký Quyết định rút giấy đăng ký lưu hành 22 loại thuốc thuộc 6 cơ sở đăng ký, sản xuất ra khỏi danh mục các thuốc được cấp giấy đăng ký lưu hành tại Việt Nam do cơ sở đăng ký thuốc không có nhu cầu kinh doanh.
Trong đó có dung dịch tiêm truyền Oplatin của Công ty TNHH Reliv pharma (TPHCM), viên nén bao phim Rustatin của công ty CP Korea United Pharm. Int’l; dung dịch tiêm Medphatobra của Cty TNHH Dược phẩm Phương Đài; viên nén bao phim Copegus của công ty F.Hoffmann-La Roche Ltd; viên nén bao phim Bondronat của công ty Productos Roche S.A.de C.V; viên nang cứng Loperamide 2mg của Glaxomithkline Pte. Ltd; 2 sản phẩm của Kujjie Pharma Inc; 6 sản phẩm của công ty Hutecs Korrea Pharmaceutical….
Cục Quản lý Dược yêu cầu, các cơ sở đăng ký thuốc, nhà sản xuất các thuốc này phải có trách nhiệm theo dõi, chịu trách nhiệm về chất lượng, an toàn, hiệu quả của thuốc trong quá trình lưu hành cho đến khi hết hạn dùng của thuốc đối với các thuốc đề nghị rút giấy đăng ký lưu hành đã được sản xuất, nhập khẩu trước ngày 21/6/2018.
Nhân Hà
Video đang HOT
Theo Dân trí
Cung ứng vắc xin dại tăng đột biến gấp 147%
Ngày 24/5, Cục Quản lý Dược (Bộ Y tế) cho biết, khả năng cung ứng vắc xin phòng dại trong năm 2018 cho thị trường Việt Nam là hơn 2,1 triệu liều, cao gấp 147% so với tổng số lượng vắc xin phòng dại đã nhập khẩu trong năm 2017 và cao gấp 166% so với số lượng vắc xin phòng dại sử dụng trung bình mỗi năm.
Ông Đỗ Văn Đông, Phó Cục trưởng Cục Quản lý Dược (Bộ Y tế) cho biết, cho đến thời điểm hiện tại theo báo cáo của các Công ty, các công ty cam kết nhập khẩu vắc xin theo đúng kế hoạch, tiến độ đã gửi như sau:
- Vắc xin Verorab: 444.540 liều (căn cứ Công văn số 362/SPC-XNK ngày 10/5/2018 của Công ty TNHH MTV Dược Sài Gòn).
- Vắc xin Ahayrab: khoảng 1.400.000 liều (căn cứ Công văn số 01/CV-ĐM ngày 25/4/2018 của Công ty Cổ phần Y tế Đức Minh).
- Vắc xin Indirab: khoảng 300.000 liều (căn cứ Công văn số 02/CV-AMV ngày 25/4/2018 của Công ty cổ phần y tế AMV Group).
- Từ đầu năm 2018 đến nay, vắc xin Speeda đã nhập khẩu 2.200 liều; dự kiến giữa tháng 6 nhập khẩu tiếp 4.000 liều và cuối tháng 6 nhập khẩu tiếp 6.000 liều. Nếu các cơ sở tiêm chủng có nhu cầu thì cơ sở tiếp tục nhập khẩu các lô hàng tiếp theo.
Như vậy, khả năng cung ứng vắc xin phòng dại trong năm 2018 cho thị trường Việt Nam là 2.156.740 liều (cao gấp 147% so với tổng số lượng vắc xin phòng dại đã nhập khẩu trong năm 2017 và cao gấp 166% so với số lượng vắc xin phòng dại sử dụng trung bình mỗi năm).
Lãnh đạo Cục Quản lý Dược cho biết thêm, sau cuộc họp ngày 11/5/2018 với các đơn vị, Sở Y tế liên quan về việc cung ứng, sử dụng vắc xin dại, Lãnh đạo Bộ Y tế đã chỉ đạo các Sở Y tế giao công tác điều phối vắc xin phòng bệnh dại cho Trung tâm Kiểm soát bệnh truyền nhiễm hoặc Trung tâm Y tế dự phòng tỉnh, thành phố, cần tham mưu Ủy ban nhân dân dành kinh phí cho dự trữ.
Trong hợp đồng cung ứng vắc xin giữa các cơ sở cung ứng với các đơn vị tiêm chủng cần thể hiện dưới dạng hợp đồng chi tiết, có số lượng, giá từng loại vắc xin và thời gian giao hàng, đồng thời nêu rõ ràng trách nhiệm của các bên trong quá trình thực hiện hợp đồng.
Các đơn vị tiêm chủng phải có dự trữ số lượng vắc xin tại kho để đủ đáp ứng nhu cầu tiêm chủng trong ít nhất một tháng để đảm bảo không bị gián đoạn khi một loại vắc xin nào đó có vấn đề về nguồn cung.
Các Sở Y tế có sự phối hợp lẫn nhau trong việc chia sẻ bệnh nhân, lượng vắc xin sẵn có trong những trường hợp cần thiết, nhất là tại nơi có thiếu cục bộ. Hợp đồng cung ứng vắc xin dại nên ký với các loại vắc xin của các nhà phân phối khác nhau, không nên chỉ sử dụng một loại vắc xin của một nhà cung ứng ngay cả khi nguồn cung vắc xin đảm bảo để tránh bị phụ thuộc quá lớn vào một nguồn cung nào đó.
Trong trường hợp đơn vị tiêm chủng nào có vướng mắc trong khâu đấu thầu, đề nghị báo cáo ngay Lãnh đạo Sở Y tế, Ủy ban nhân dân tỉnh để có thể tiến hành chỉ định thầu vắc xin. Trường hợp cần thiết, đề nghị có văn bản gửi về Cục Quản lý Dược, Vụ Kế hoạch - Tài chính để được hướng dẫn. Các nhà sản xuất, nhập khẩu, cung ứng vắc xin có trách nhiệm phải báo cáo kịp thời về Cục Quản lý Dược theo luật các trường hợp có nguy cơ ảnh hưởng đến tiến độ cung ứng vắc xin phòng dại tại Việt Nam như chậm, thiếu hoặc ngừng cung cấp vắc xin.
Bộ Y tế cũng Giao Cục Y tế dự phòng liên lạc ngay với Trung tâm Kiểm soát bệnh truyền nhiễm hoặc Trung tâm Y tế dự phòng tỉnh để ghi nhận địa phương nào còn, địa phương nào hết nhằm tiến hành điều phối kịp thời giữa các cơ sở.
Đồng thời khẩn trương chỉ đạo, tổ chức hướng dẫn, kiểm tra các hoạt động giám sát, thông tin, báo cáo và triển khai các biện pháp phòng, chống bệnh dại trên người trên phạm vi cả nước. Phối hợp chia sẻ thông tin về bệnh dịch với Cục Thú y (Bộ Nông nghiệp và Phát triển nông thôn) và các đơn vị có liên quan khác theo quy định để phối hợp tiêm phòng cho chó và các biện pháp khác.
Tăng cường tổng hợp, dự báo nhu cầu vắc xin phòng dại cập nhật hơn và cụ thể hơn theo từng tháng, từng quý, từng địa phương và có sự chỉ đạo, điều phối lượng vắc xin phòng dại từ các cơ sở tiêm chủng đang còn tồn nhiều sang cơ sở tiêm chủng đang bị thiếu (trong những thời điểm khi tổng nguồn cung trên thị trường bị thiếu hụt tạm thời); khuyến cáo chuyển sang hình thức tiêm trong da để giảm số liều.
Các công ty nhập khẩu và phân phối vắc xin phòng dại liên hệ ngay với các đơn vị hiện đang thiếu vắc xin để cung ứng ngay lượng vắc xin còn trong kho để đáp ứng nhu cầu tiêm chủng của nhân dân. Đối với vắc xin đã nhập khẩu về, đang chờ Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế (NICVB) kiểm định, đề nghị NICVB khẩn trương kiểm định xuất lô để kịp thời phục vụ tiêm chủng.
Tú Anh
Theo Dân trí
Thu hồi dung dịch vệ sinh phụ nữ không đạt yêu cầu giới hạn vi sinh vật  Cục Quản lý Dược (Bộ Y tế) cho biết cơ quan này vừa ra quyết định đình chỉ lưu hành, thu hồi trên toàn quốc sản phẩm dung dịch vệ sinh phụ nữ dạng bọt Kare Fresh. Ảnh minh họa Theo đó, Công văn số 7378/QLD-MP do ông Đỗ Văn Đông, Phó Cục trưởng Cục Quản lý Dược ký ban hành đã quyết...
Cục Quản lý Dược (Bộ Y tế) cho biết cơ quan này vừa ra quyết định đình chỉ lưu hành, thu hồi trên toàn quốc sản phẩm dung dịch vệ sinh phụ nữ dạng bọt Kare Fresh. Ảnh minh họa Theo đó, Công văn số 7378/QLD-MP do ông Đỗ Văn Đông, Phó Cục trưởng Cục Quản lý Dược ký ban hành đã quyết...
 Vụ dụ dỗ người dân tu tập mê tín: Một bị hại phải bán 3 căn nhà ở Hà Nội01:02
Vụ dụ dỗ người dân tu tập mê tín: Một bị hại phải bán 3 căn nhà ở Hà Nội01:02 Thực hư tin Campuchia điều binh sĩ tới biên giới với Thái Lan sau vụ đối đầu08:43
Thực hư tin Campuchia điều binh sĩ tới biên giới với Thái Lan sau vụ đối đầu08:43 Xung đột Nga - Ukraine trước bước ngoặt08:59
Xung đột Nga - Ukraine trước bước ngoặt08:59 Ông Trump sẽ đích thân kiểm kê kho vàng trị giá 425 tỉ USD của Mỹ09:43
Ông Trump sẽ đích thân kiểm kê kho vàng trị giá 425 tỉ USD của Mỹ09:43 Lãnh đạo Mỹ - Ukraine khẩu chiến kịch liệt08:41
Lãnh đạo Mỹ - Ukraine khẩu chiến kịch liệt08:41 'Ông Trump rất thất vọng về ông Zelensky, muốn Ukraine thỏa thuận khoáng sản 500 tỉ USD'09:08
'Ông Trump rất thất vọng về ông Zelensky, muốn Ukraine thỏa thuận khoáng sản 500 tỉ USD'09:08 Đặc phái viên Mỹ hé lộ điều Nga - Ukraine phải làm để đạt thỏa thuận hòa bình07:56
Đặc phái viên Mỹ hé lộ điều Nga - Ukraine phải làm để đạt thỏa thuận hòa bình07:56 Mỹ sẽ điều chỉnh lệnh cấm vận Nga tùy theo thỏa thuận Ukraine08:41
Mỹ sẽ điều chỉnh lệnh cấm vận Nga tùy theo thỏa thuận Ukraine08:41 Vụ trộm bồn cầu làm bằng 98 kg vàng: nghi phạm ra tay trong 5 phút09:08
Vụ trộm bồn cầu làm bằng 98 kg vàng: nghi phạm ra tay trong 5 phút09:08 Xe mất thắng lao xuống rãnh ven đường, ít nhất 18 người thiệt mạng tại Thái Lan01:07
Xe mất thắng lao xuống rãnh ven đường, ít nhất 18 người thiệt mạng tại Thái Lan01:07 Ông Trump bất ngờ cách chức Chủ tịch Hội đồng tham mưu trưởng Liên quân Mỹ08:39
Ông Trump bất ngờ cách chức Chủ tịch Hội đồng tham mưu trưởng Liên quân Mỹ08:39Tiêu điểm
Tin đang nóng
Tin mới nhất

70-80% bệnh hiếm liên quan tới di truyền, rất ít bệnh có thuốc điều trị

Hé lộ cơ chế đằng sau tình trạng sụt cân nghiêm trọng của bệnh nhân ung thư

Top 5 loại quả giá rẻ giàu vitamin C nhất

Chinh phục phong cách tối giản dễ dàng với quần suông

Đậu nành có tốt nhất?

Ăn gan ngỗng có tốt cho sức khỏe?

Chiết xuất từ cây đại bi thay thế kháng sinh
TP.HCM sẵn sàng ứng phó khi sốt xuất huyết đến sớm

Tránh 10 sai lầm ăn sáng phổ biến này để giảm cân hiệu quả

Loại quả được ví như 'bánh mì', bổ ngang nhân sâm tổ yến cực nhiều ở Việt Nam

Cẩn thận với hội chứng người đỏ do thuốc

Uống nước lá rau mùi có lợi gì với sức khỏe?
Có thể bạn quan tâm

Mỹ nhân Việt đóng phim nào flop thảm phim đó, tiếc cho nhan sắc đẹp ngất ngây lòng người
Hậu trường phim
23:59:38 28/02/2025
Nam Thư đã bí mật sinh con?
Sao việt
23:56:58 28/02/2025
Drama bủa vây 2 mỹ nam đình đám hậu chia tay: 1 người liên tục "đu bám" người cũ, fan phát hiện chi tiết dối trá
Sao châu á
23:46:08 28/02/2025
Công bố cuộc gọi cầu cứu ám ảnh trong vụ vợ chồng nam diễn viên hàng đầu tử vong bất thường cùng chú chó cưng
Sao âu mỹ
23:04:55 28/02/2025
Lộ bằng chứng Lisa (BLACKPINK) được biểu diễn tại Oscar nhờ bạn trai tỷ phú?
Nhạc quốc tế
22:09:43 28/02/2025
RHYDER lần đầu làm 1 chuyện gây sốc
Nhạc việt
22:05:23 28/02/2025
Thấy người đàn ông bị mắc kẹt dưới gầm ô tô, hàng chục người dân Đắk Lắk có hành động bất ngờ
Netizen
22:05:17 28/02/2025
Nga đánh giá vòng đàm phán mới với Mỹ thiết thực và thực chất
Thế giới
20:12:02 28/02/2025
 Mắt bỏng rát có thể là dấu hiệu của những vấn đề sức khỏe nghiêm trọng
Mắt bỏng rát có thể là dấu hiệu của những vấn đề sức khỏe nghiêm trọng Hà Nội: Ngang nhiên sản xuất mỹ phẩm chưa có phép
Hà Nội: Ngang nhiên sản xuất mỹ phẩm chưa có phép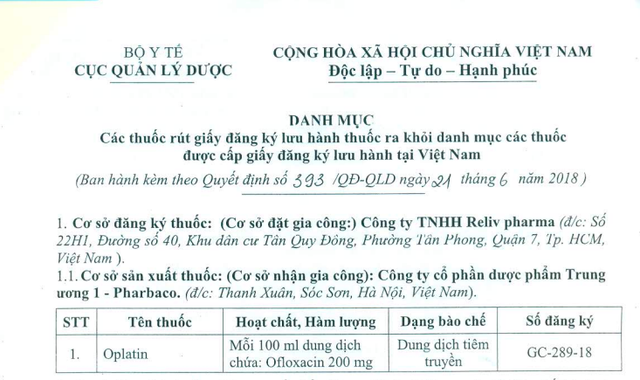
 Thu hồi 1 loại thuốc điều trị phù nề sau chấn thương
Thu hồi 1 loại thuốc điều trị phù nề sau chấn thương Thu hồi 4 hóa mỹ phẩm do không đáp ứng quy định ghi nhãn
Thu hồi 4 hóa mỹ phẩm do không đáp ứng quy định ghi nhãn Bộ Y tế yêu cầu tập trung kiểm nghiệm vắc xin thay thế Quinvaxem
Bộ Y tế yêu cầu tập trung kiểm nghiệm vắc xin thay thế Quinvaxem Phạt 280 triệu đồng 3 công ty dược
Phạt 280 triệu đồng 3 công ty dược Không đạt chỉ tiêu về hàm lượng, thuốc chữa tiêu hóa bị đình chỉ lưu hành
Không đạt chỉ tiêu về hàm lượng, thuốc chữa tiêu hóa bị đình chỉ lưu hành Cục Quản lý dược hướng dẫn phân biệt thuốc bôi da thật và nghi ngờ giả
Cục Quản lý dược hướng dẫn phân biệt thuốc bôi da thật và nghi ngờ giả Thiếu nữ tổn thương não do nhiễm khuẩn từ những nốt mụn trứng cá
Thiếu nữ tổn thương não do nhiễm khuẩn từ những nốt mụn trứng cá Uống cà phê kiểu này cực tốt cho cơ thế nhưng không phải ai cũng biết
Uống cà phê kiểu này cực tốt cho cơ thế nhưng không phải ai cũng biết Sinh mổ ngoài ý muốn có thể làm tăng nguy cơ trầm cảm sau sinh
Sinh mổ ngoài ý muốn có thể làm tăng nguy cơ trầm cảm sau sinh 5 loại thuốc cần uống nhiều nước
5 loại thuốc cần uống nhiều nước Dầu ô liu và dầu dừa, loại nào tốt cho sức khỏe hơn?
Dầu ô liu và dầu dừa, loại nào tốt cho sức khỏe hơn? Dậy sớm có đáng sợ hơn thức khuya?
Dậy sớm có đáng sợ hơn thức khuya? 4 lý do cản trở việc giảm cân ở tuổi trung niên
4 lý do cản trở việc giảm cân ở tuổi trung niên Bác sĩ chỉ ra khung giờ tốt nhất để đi bộ cho người già
Bác sĩ chỉ ra khung giờ tốt nhất để đi bộ cho người già Kỳ thú hiện tượng "Thất tinh liên châu" - 7 hành tinh hội tụ hiếm gặp, ở Việt Nam quan sát được không?
Kỳ thú hiện tượng "Thất tinh liên châu" - 7 hành tinh hội tụ hiếm gặp, ở Việt Nam quan sát được không? Ầm ĩ nhất MXH: Thiều Bảo Trâm bị hội chị em "quay lưng", Hải Tú chỉ là nạn nhân?
Ầm ĩ nhất MXH: Thiều Bảo Trâm bị hội chị em "quay lưng", Hải Tú chỉ là nạn nhân? Đình chỉ cô giáo đang giờ thi viết đáp án lên bảng cho học sinh chép
Đình chỉ cô giáo đang giờ thi viết đáp án lên bảng cho học sinh chép Quá khứ xấu hổ của Doãn Hải My bị công khai, Đoàn Văn Hậu nhận hình phạt lạnh lẽo từ bà xã
Quá khứ xấu hổ của Doãn Hải My bị công khai, Đoàn Văn Hậu nhận hình phạt lạnh lẽo từ bà xã Bài văn tả ông hàng xóm của học sinh lớp 5 bị cô giáo chấm 4 điểm kèm lời phê "phụ huynh cần xem lại", dân mạng cãi nhau ầm ĩ
Bài văn tả ông hàng xóm của học sinh lớp 5 bị cô giáo chấm 4 điểm kèm lời phê "phụ huynh cần xem lại", dân mạng cãi nhau ầm ĩ Mẹ nuôi tiết lộ bí mật, cô gái Pháp tìm thấy bố mẹ Việt sau 6 ngày
Mẹ nuôi tiết lộ bí mật, cô gái Pháp tìm thấy bố mẹ Việt sau 6 ngày Bạn gái Bạch Kính Đình được nhắc tên liên tục khi phim "Khó dỗ dành" gây sốt
Bạn gái Bạch Kính Đình được nhắc tên liên tục khi phim "Khó dỗ dành" gây sốt Tình trạng hiện tại của chồng Hàn Từ Hy Viên gây sốc
Tình trạng hiện tại của chồng Hàn Từ Hy Viên gây sốc Nữ nghệ sĩ đình đám đã bán nốt biệt thự 70 tỷ ở Việt Nam
Nữ nghệ sĩ đình đám đã bán nốt biệt thự 70 tỷ ở Việt Nam Phẫu thuật không gây mê, bác sĩ khiến người phụ nữ tử vong
Phẫu thuật không gây mê, bác sĩ khiến người phụ nữ tử vong Nửa đêm, mẹ Bắp bất ngờ tung "sao kê online", nói rõ lý do không thể về Việt Nam trong 4 tháng tới
Nửa đêm, mẹ Bắp bất ngờ tung "sao kê online", nói rõ lý do không thể về Việt Nam trong 4 tháng tới Người mẹ nguy kịch vì bị con trai tạt xăng dã man: "Tôi không bao giờ giận con..."
Người mẹ nguy kịch vì bị con trai tạt xăng dã man: "Tôi không bao giờ giận con..."
 Mẹ Bắp lên tiếng về chiến dịch gây quỹ trên Give.Asia và mối quan hệ với gia đình chồng cũ
Mẹ Bắp lên tiếng về chiến dịch gây quỹ trên Give.Asia và mối quan hệ với gia đình chồng cũ Mẹ bé Bắp: 'Ba mẹ ở quê đi chợ mua đồ nhưng không ai bán, nhà có gì ăn nấy'
Mẹ bé Bắp: 'Ba mẹ ở quê đi chợ mua đồ nhưng không ai bán, nhà có gì ăn nấy' Tình thế hiện tại của vợ chồng Công Vinh - Thuỷ Tiên
Tình thế hiện tại của vợ chồng Công Vinh - Thuỷ Tiên Chồng H'Hen Niê có 1 hành động chứng minh nàng Hậu là cô gái số hưởng của Vbiz!
Chồng H'Hen Niê có 1 hành động chứng minh nàng Hậu là cô gái số hưởng của Vbiz! Nóng: Báo Hàn "bắt gọn" Lee Jong Suk hẹn hò Moon Ga Young, chuyện tình với IU đã toang?
Nóng: Báo Hàn "bắt gọn" Lee Jong Suk hẹn hò Moon Ga Young, chuyện tình với IU đã toang?