Việt Nam thu hồi 3 sản phẩm chì kẻ mắt, nước hoa của Dior
Cục Quản lý Dược vừa quyết định đình chỉ, thu hồi một loại chì kẻ mắt của Dior vì chứa propylparaben vượt quá giới hạn cho phép.
Theo đó, Cục Quản lý Dược quyết định thu hồi số tiếp nhận Phiếu công bố đối với ba sản phẩm mỹ phẩm của Dior (Pháp) sản xuất, Công ty L-Beauty Việt Nam nhập khẩu và phân phối ra thị trường. Các sản phẩm này đồng thời bị đình chỉ lưu hành và bị thu hồi.
(Ảnh minh họa)
3 sản phẩm này gồm: chì kẻ chân mày Dior Sourcils Poudre Crayon à sourcils mine poudre Power Eyebrow Pencil (093-Black;593-Brown; 453-Sand); hai loại nước hoa Dior Homme Sport very cool spray fresh eau de toillete và Dior J’Adore L’or Essence de Parfum.
Video đang HOT
Lý do, chì kẻ mắt chứa propylparaben có hàm lượng vượt quá giới hạn cho phép theo quy định của ASEAN. Hai sản phẩm còn lại có thành phần ghi trên nhãn và công thức sản xuất không đúng như hồ sơ đã công bố.
Cục Dược yêu cầu thu hồi toàn bộ các lô mỹ phẩm không đáp ứng quy định; gửi báo cáo về Cục trước ngày 25/4. Sở Y tế các địa phương có trách nhiệm kiểm tra, giám sát việc thu hồi các mỹ phẩm này.
Các dẫn chất paraben được sử dụng phổ biến trong thành phần mỹ phẩm với vai trò bảo quản. Paraben là chất kháng khuẩn và kháng nấm, giúp ngăn ngừa sự nhiễm khuẩn và hạn chế sự phân hủy của các hoạt chất dẫn đến giảm hiệu quả thuốc, mỹ phẩm.
5 dẫn chất paraben bị cấm dùng trong mỹ phẩm gần đây vì nghi ngờ gây ung thư vú gồm isopropylparaben, isobutylparaben, phenylparaben, benzylparaben và pentylparaben. Theo Hội đồng khoa học châu Âu, chưa có công bố cụ thể nào về tác hại của sản phẩm có chứa các thành phần này. Tuy nhiên, để đảm bảo lợi ích và an toàn cho người tiêu dùng, Cộng đồng châu Âu và Hội đồng Mỹ phẩm ASEAN đã khuyến cáo ngưng sử dụng các chất này và thay thế bằng chất bảo quản an toàn hơn.
Riêng dẫn chất propylparaben và các muối được phép dùng riêng lẻ với nồng độ tối đa 0,14%; dạng hỗn hợp các paraben với tổng nồng độ tối đa là 0,8% (tính theo acid).
Theo vnexpress.net
Bộ Y tế ra thông tư quy định ghi nhãn thuốc, nguyên liệu làm thuốc
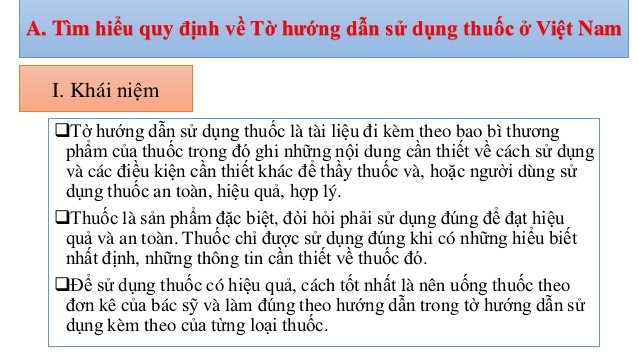
Bộ trưởng Bộ Y tế vừa ban hành Thông tư quy định ghi nhãn thuốc, nguyên liệu làm thuốc và tờ hướng dẫn sử dụng thuốc.
Theo Thông tư nhãn bao bì ngoài của thuốc phải thể hiện các nội dung: Tên thuốc; Dạng bào chế; Thành phần, hàm lượng, khối lượng hoặc nồng độ của dược chất, dược liệu trong công thức thuốc; Quy cách đóng gói; Chỉ định, cách dùng, chống chỉ định của thuốc; Số giấy đăng ký lưu hành hoặc số giấy phép nhập khẩu (nếu có); Số lô sản xuất, ngày sản xuất, hạn dùng của thuốc, tiêu chuẩn chất lượng, điều kiện bảo quản thuốc; Các dấu hiệu lưu ý và khuyến cáo khi dùng thuốc; Tên cơ sở sản xuất thuốc, địa chỉ cơ sở sản xuất thuốc; Tên, địa chỉ của cơ sở nhập khẩu (đối với thuốc nhập khẩu); Xuất xứ của thuốc.
Quy định khắt khe về nhãn thuốc, tờ rơi sử dụng thuốc nhằm giúp người bệnh sử dụng thuốc an toàn, hiệu quả.
Nhãn bao bì ngoài của nguyên liệu làm thuốc (bao gồm cả dược liệu, vị thuốc cổ truyền, bán thành phẩm dược liệu, bán thành phẩm thuốc) phải thể hiện các nội dung: Tên nguyên liệu làm thuốc; Khối lượng hoặc thể tích của nguyên liệu làm thuốc trong một đơn vị đóng gói nhỏ nhất; Tiêu chuẩn chất lượng của nguyên liệu làm thuốc; Số giấy đăng ký lưu hành hoặc số giấy phép nhập khẩu (nếu có); Số lô sản xuất, ngày sản xuất, hạn dùng, điều kiện bảo quản của nguyên liệu làm thuốc; Tên, địa chỉ của cơ sở sản xuất nguyên liệu làm thuốc;Tên, địa chỉ của cơ sở nhập khẩu nguyên liệu làm thuốc (đối với nguyên liệu làm thuốc nhập khẩu); Xuất xứ của nguyên liệu làm thuốc.
Nguyên liệu là dược chất, dược liệu hoặc bán thành phẩm thuốc có chứa dược chất, dược liệu thuộc Danh mục dược chất gây nghiện, hướng thần, tiền chất làm thuốc, nguyên liệu độc làm thuốc, dược liệu độc, nguyên liệu phóng xạ làm thuốc, phải ghi trên nhãn bao bì ngoài các dòng chữ tương ứng như sau: "Nguyên liệu gây nghiện", "Nguyên liệu hướng thần", "Nguyên liệu tiền chất làm thuốc", "Nguyên liệu độc", "Dược liệu độc", "Nguyên liệu phóng xạ".
Nhãn bao bì ngoài của thuốc cổ truyền, thuốc pha chế ngoài việc ghi tên thuốc, khối lượng, tiêu chuẩn chất lượng... cần phải ghi rõ tên, địa chỉ của cơ sở khám bệnh, chữa bệnh sản xuất, pha chế, chế biến, bào chế, cân (bốc) thuốc...
Ngoài ra, Thông tư cũng quy định rõ về tờ hướng dẫn sử dụng thuốc, nhằm giúp người bệnh sử dụng thuốc hiệu quả, an toàn. Thông tư gồm 4 chương, 40 điều.
Theo Danviet
Cải cách, minh bạch thông tin trong giải quyết hồ sơ đăng ký lưu hành thuốc  Với chủ trương, giải pháp cải tiến, minh bạch thông tin về đăng ký thuốc, Cục Quản lý Dược hy vọng sẽ đáp ứng từng bước nhu cầu của doanh nghiệp, xã hội. Cục Quản lý Dược đã có những giải pháp cải tiến, minh bạch trong việc đăng ký hồ sơ lưu hành thuốc. (Ảnh minh họa: Thông tấn xã Việt Nam)...
Với chủ trương, giải pháp cải tiến, minh bạch thông tin về đăng ký thuốc, Cục Quản lý Dược hy vọng sẽ đáp ứng từng bước nhu cầu của doanh nghiệp, xã hội. Cục Quản lý Dược đã có những giải pháp cải tiến, minh bạch trong việc đăng ký hồ sơ lưu hành thuốc. (Ảnh minh họa: Thông tấn xã Việt Nam)...
 Clip nghi phạm đốt quán hát khiến 11 người chết ở Hà Nội01:29
Clip nghi phạm đốt quán hát khiến 11 người chết ở Hà Nội01:29 Lý do quán 'Hát cho nhau nghe' bị phóng hỏa khiến 11 người tử vong ở Hà Nội02:17
Lý do quán 'Hát cho nhau nghe' bị phóng hỏa khiến 11 người tử vong ở Hà Nội02:17 Tìm thấy thi thể nữ tài xế, xuyên đêm trục vớt ô tô rơi sông Đồng Nai01:29
Tìm thấy thi thể nữ tài xế, xuyên đêm trục vớt ô tô rơi sông Đồng Nai01:29 Cuộc gọi vô vọng của người nhà nạn nhân tử vong trong vụ cháy ở Hà Nội09:51
Cuộc gọi vô vọng của người nhà nạn nhân tử vong trong vụ cháy ở Hà Nội09:51 Nội bộ Mỹ mâu thuẫn về Ukraine?08:24
Nội bộ Mỹ mâu thuẫn về Ukraine?08:24 Diễn biến vụ nghi phạm đốt quán 'Hát cho nhau nghe' làm 11 người tử vong01:02
Diễn biến vụ nghi phạm đốt quán 'Hát cho nhau nghe' làm 11 người tử vong01:02 Nga liên lạc với 'lực lượng mạnh nhất' ở Syria14:18
Nga liên lạc với 'lực lượng mạnh nhất' ở Syria14:18 Vụ cướp giả cảnh sát hình sự: Dàn dựng ly kỳ như phim hành động09:21
Vụ cướp giả cảnh sát hình sự: Dàn dựng ly kỳ như phim hành động09:21 Nga phóng gần 300 tên lửa và UAV, Ukraine điều F-16 ứng phó?08:24
Nga phóng gần 300 tên lửa và UAV, Ukraine điều F-16 ứng phó?08:24 Chính phủ mới Syria muốn Nga 'xem xét lại' hiện diện quân sự08:31
Chính phủ mới Syria muốn Nga 'xem xét lại' hiện diện quân sự08:31 Chàng trai 20 tuổi kể lại khoảnh khắc lao vào cứu hộ trong vụ cháy quán cà phê02:26
Chàng trai 20 tuổi kể lại khoảnh khắc lao vào cứu hộ trong vụ cháy quán cà phê02:26Tiêu điểm
Tin đang nóng
Tin mới nhất

Điều ước Giáng sinh của những em bé chỉ mong sớm được về nhà, cho mẹ đỡ cực
Nhiều bệnh nhân ung thư sống thêm 10-20 năm

Ba không trước khi massage

Lợi ích khó ngờ từ việc điều chỉnh kiểu đi bộ khác thông thường

Cà phê có thực sự tốt cho sức khỏe tim mạch?

Hiểm họa từ đốt than sưởi ấm: Người dân cần lưu ý gì?

Tăng mạnh tỷ lệ mắc căn bệnh "thời đại số", ảnh hưởng sức khỏe nghiêm trọng
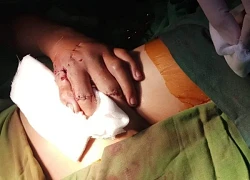
Bệnh nhân 15 tuổi dập nát một bàn tay do chơi pháo tự chế

Kinh tế Mỹ tiếp tục khởi sắc
Nam Phi ra cảnh báo về bệnh rubella sau khi ghi nhận hơn 10.000 ca mắc
Tiêm mỡ nhân tạo ở Hồng Kông, nữ Việt kiều phải mổ ngực biến dạng nặng nề

Những điều nên và không nên làm khi có người bị đột quỵ
Có thể bạn quan tâm

Lợi dụng danh nghĩa báo chí để trục lợi tiền tỷ, vợ chồng Lê Danh Tạo lĩnh án tù
Pháp luật
13:39:51 21/12/2024
CĂNG: Phan Đạt tung clip 47 phút đáp trả Phương Lan, 1 chi tiết dấy lên tranh cãi dữ dội
Sao việt
13:25:49 21/12/2024
"Khoe" thu nhập tháng 110 triệu nhưng khi tiết lộ tiền học cho con, bà mẹ Hải Phòng bị "ném đá": Chị có nhầm không?
Netizen
13:22:35 21/12/2024
Mỹ nam cứ đóng phim với ai là người đó bị phong sát, đẹp như tượng tạc nhưng xui xẻo không ai bằng
Hậu trường phim
13:18:47 21/12/2024
Nụ hôn hơn 1 phút của tổng tài không cứu nổi rating đi xuống của When the Phone Rings
Phim châu á
13:13:07 21/12/2024
Măng tô là kiểu áo khoác 'cân đẹp' mọi vóc dáng
Thời trang
12:57:26 21/12/2024
5 công thức ủ tóc dễ thực hiện tại nhà
Làm đẹp
12:55:41 21/12/2024
Những khoáng vật tự nhiên quý hiếm có đặc tính kỳ lạ trên thế giới
Lạ vui
12:45:58 21/12/2024
Hà Nội: 2 người tử vong, 14 người nhập viện sau bữa tiệc
Tin nổi bật
12:44:17 21/12/2024
Tử vi 12 cung hoàng đạo ngày 21/12: Kim Ngưu khó khăn, Ma Kết phát triển
Trắc nghiệm
11:45:29 21/12/2024
 Bí quyết trường thọ của Tống Mỹ Linh
Bí quyết trường thọ của Tống Mỹ Linh 8 dấu hiệu cảnh báo cơ thể bạn thiếu vitamin trầm trọng
8 dấu hiệu cảnh báo cơ thể bạn thiếu vitamin trầm trọng
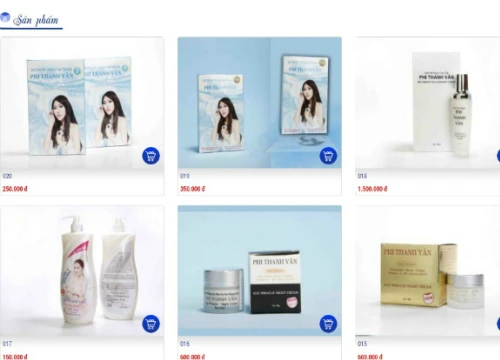 Công ty mỹ phẩm của diễn viên Phi Thanh Vân bị đình chỉ hoạt động
Công ty mỹ phẩm của diễn viên Phi Thanh Vân bị đình chỉ hoạt động Vụ VN Pharma: Cục Quản lý dược không ký, 8 hồ sơ giả có dễ dàng "chui lọt"?
Vụ VN Pharma: Cục Quản lý dược không ký, 8 hồ sơ giả có dễ dàng "chui lọt"? Bộ Y tế quyết H-Capita không phải thuốc giả
Bộ Y tế quyết H-Capita không phải thuốc giả Cục Quản lý Dược chính thức trả lời câu hỏi của Tòa án liên quan vụ thuốc ung thư giả
Cục Quản lý Dược chính thức trả lời câu hỏi của Tòa án liên quan vụ thuốc ung thư giả Ngày cuối xử vụ VN Pharma: Vì sao tòa vẫn chưa thể tuyên án?
Ngày cuối xử vụ VN Pharma: Vì sao tòa vẫn chưa thể tuyên án? Tổng giám đốc VN Pharma xin giảm nhẹ cho thuộc cấp
Tổng giám đốc VN Pharma xin giảm nhẹ cho thuộc cấp Nạn nhân vụ cháy quán cà phê ở Hà Nội nguy cơ nặng lên, phải chuyển viện
Nạn nhân vụ cháy quán cà phê ở Hà Nội nguy cơ nặng lên, phải chuyển viện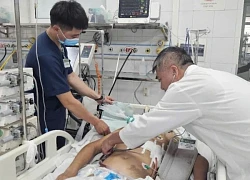 Hà Nội: Người đàn ông thủng tim vì ngã từ tầng 3, bệnh viện "báo động đỏ"
Hà Nội: Người đàn ông thủng tim vì ngã từ tầng 3, bệnh viện "báo động đỏ"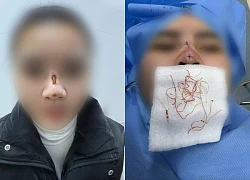 Cô gái trẻ ở Hà Nội thủng mũi, lộ chỉ chi chít
Cô gái trẻ ở Hà Nội thủng mũi, lộ chỉ chi chít Thủng nội tạng sau khi tự chữa đau lưng
Thủng nội tạng sau khi tự chữa đau lưng Ăn những loại thực phẩm này có thể giúp bạn ngủ ngon hơn
Ăn những loại thực phẩm này có thể giúp bạn ngủ ngon hơn Suy giảm trí nhớ và cách khắc phục
Suy giảm trí nhớ và cách khắc phục Thời điểm dễ khiến bệnh tim trở nặng
Thời điểm dễ khiến bệnh tim trở nặng Chuyên gia nội tiết cảnh báo nguy cơ mỡ máu, tiểu đường từ đồ ăn vặt thường ngày
Chuyên gia nội tiết cảnh báo nguy cơ mỡ máu, tiểu đường từ đồ ăn vặt thường ngày Mẹ chồng Hà Nội bắt con dâu ký tên vào giấy khước từ tài sản mới chia đất, cô gái tuyên bố từ nay chỉ sống vì mình: Ai đúng ai sai?
Mẹ chồng Hà Nội bắt con dâu ký tên vào giấy khước từ tài sản mới chia đất, cô gái tuyên bố từ nay chỉ sống vì mình: Ai đúng ai sai? Phương Lan viết tâm thư tố căng hậu ly hôn, Phan Đạt: "Giờ ra đòn mới hả?"
Phương Lan viết tâm thư tố căng hậu ly hôn, Phan Đạt: "Giờ ra đòn mới hả?" Công an Hà Nội phối hợp Interpol truy nã quốc tế Mr Hunter Lê Khắc Ngọ
Công an Hà Nội phối hợp Interpol truy nã quốc tế Mr Hunter Lê Khắc Ngọ Sao Việt 21/12: Midu tình tứ bên ông xã, Nhã Phương khác lạ khó nhận ra
Sao Việt 21/12: Midu tình tứ bên ông xã, Nhã Phương khác lạ khó nhận ra Triệu Lệ Dĩnh tạo hình khác lạ trong phim hợp tác cùng Huỳnh Hiểu Minh
Triệu Lệ Dĩnh tạo hình khác lạ trong phim hợp tác cùng Huỳnh Hiểu Minh Vừa đổ bệnh thì vợ có nhân tình, anh tôi bỏ 300 nghìn làm một việc khiến chị dâu sợ hãi đến già
Vừa đổ bệnh thì vợ có nhân tình, anh tôi bỏ 300 nghìn làm một việc khiến chị dâu sợ hãi đến già Cuối năm vác bụng bầu đi đánh ghen, tôi thất vọng bỏ về sau câu nói của bố chồng
Cuối năm vác bụng bầu đi đánh ghen, tôi thất vọng bỏ về sau câu nói của bố chồng Thanh niên 21 tuổi bị đồng hương sát hại ở TPHCM
Thanh niên 21 tuổi bị đồng hương sát hại ở TPHCM Danh tính 11 nạn nhân tử vong trong vụ cháy quán cà phê
Danh tính 11 nạn nhân tử vong trong vụ cháy quán cà phê Người phụ nữ gửi tiết kiệm 3 tỷ đồng, 5 năm sau đi rút tài khoản chỉ còn 3 nghìn: Cảnh sát vào cuộc vạch trần thủ đoạn tinh vi, ngân hàng cũng không ngờ tới
Người phụ nữ gửi tiết kiệm 3 tỷ đồng, 5 năm sau đi rút tài khoản chỉ còn 3 nghìn: Cảnh sát vào cuộc vạch trần thủ đoạn tinh vi, ngân hàng cũng không ngờ tới
 Nhanh chóng xác định danh tính các nạn nhân vụ cháy quán cafe
Nhanh chóng xác định danh tính các nạn nhân vụ cháy quán cafe Sao nam hạng A gây sốc vì cưỡng hôn nữ thần sắc đẹp ngay trên sóng trực tiếp, ai ngờ nhận quả báo cực đắng
Sao nam hạng A gây sốc vì cưỡng hôn nữ thần sắc đẹp ngay trên sóng trực tiếp, ai ngờ nhận quả báo cực đắng Vụ cháy 11 người chết: Xót xa người tử nạn nằm ở các tầng và nhà vệ sinh
Vụ cháy 11 người chết: Xót xa người tử nạn nằm ở các tầng và nhà vệ sinh Mua nhà 15 năm thì bị phá dỡ, người phụ nữ được đền bù 14,6 tỷ đồng nhưng chủ cũ quay lại đòi chia tiền, toà tuyên bố: Chị phải trả cho họ một phần tài sản
Mua nhà 15 năm thì bị phá dỡ, người phụ nữ được đền bù 14,6 tỷ đồng nhưng chủ cũ quay lại đòi chia tiền, toà tuyên bố: Chị phải trả cho họ một phần tài sản Sốc: Nữ diễn viên hạng A ly hôn không phải vì chồng ngoại tình với trợ lý, mà bị nhà chồng "hút máu" đến cùng cực?
Sốc: Nữ diễn viên hạng A ly hôn không phải vì chồng ngoại tình với trợ lý, mà bị nhà chồng "hút máu" đến cùng cực? Phương Lan tiết lộ thông tin sốc căn nhà được gia đình Phan Đạt tặng trong lễ cưới?
Phương Lan tiết lộ thông tin sốc căn nhà được gia đình Phan Đạt tặng trong lễ cưới? HOT: "Hoàng tử nụ cười" James Jirayu chính thức kết hôn với bạn gái ngoài ngành hơn 4 tuổi
HOT: "Hoàng tử nụ cười" James Jirayu chính thức kết hôn với bạn gái ngoài ngành hơn 4 tuổi