Thực hư chuyện thuốc chứa Valsartan gây ung thư
Hơn một tháng qua, dư luận ồn ào vì 22 quốc gia đồng loạt cấm thuốc Trung Quốc chứa chất valsartan , hoặc những thuốc bào chế trong nước mình nhập nguyên liệu valsartan có xuất xứ từ Trung Quốc.
Valsartan là nguyên liệu dùng để sản xuất thuốc điều trị cao huyết áp , suy tim . Thông tin thuốc này chứa chất gây ung thư khiến cho rất nhiều bệnh nhân lo lắng (ảnh minh họa)
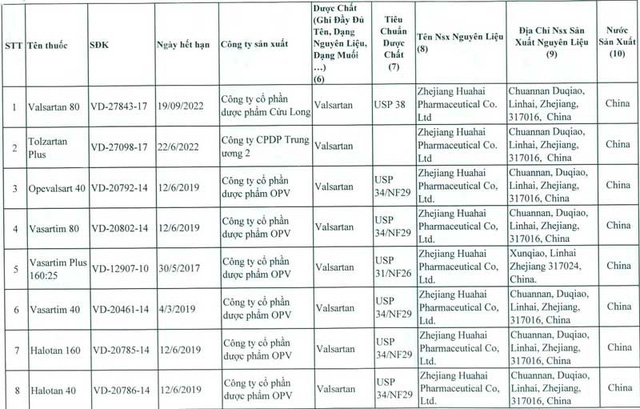
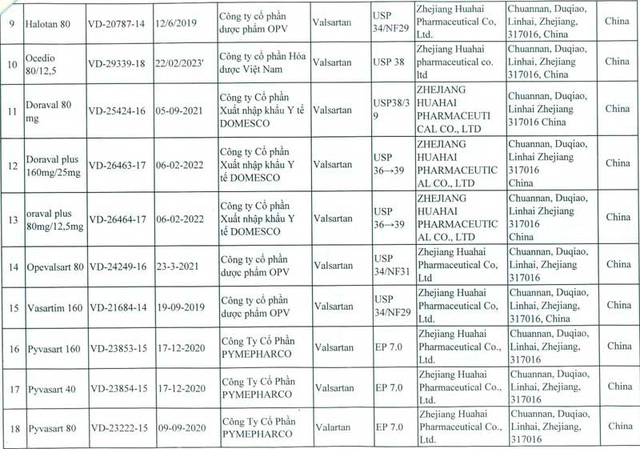
Đầu tháng 7, Cơ quan quản lý dược phẩm Châu Âu (EMA), Canada và một số nước khác đã thu hồi các thuốc có thành phần valsartan do công ty (CT) Zhejiang Huahai Pharmaceutical (ZHP hay Hoa Hải), ở Chiết Giang, Trung Quốc cung cấp vì chứa chất N – nitrosodimethylamine (NDMA) gây ung thư. EMA đã đình chỉ lưu hành, thu hồi 23 loại thuốc trên thị trường có chứa hoạt chất NDMA . Sau Châu Âu và Canada, đến Mỹ thu hồi sản phẩm này. Ngày 13.7, Cục Quản lý dược Việt Nam thông báo thu hồi 23 loại thuốc chứa chất valsartan có nguồn gốc từ CT Hoa Hải, được xác định chứa NDMA, trong đó 9 loại do các CT dược nhập valsartan từ Hoa Hải về bào chế trong nước và 14 loại thành phẩm nhập từ Ấn Độ, Bangladesh, Ba Lan, Tây Ban Nha, Pakistan, Bungari… mà các nước này cũng dùng nguyên liệu valsartan của Hoa Hải. Còn lại 88 loại thuốc chứa valtarsan nhưng nguồn gốc nguyên liệu không phải từ ZHP vẫn được phép lưu hành.
Bị thu hồi trên diện rộng
Theo rà soát của Cục Quản lý dược, 23 loại thuốc trên có ở 8 CT được đăng ký, trong đó có 4 CT đang niêm yết trên thị trường chứng khoán là: CT cổ phần nhập khẩu y tế DOMESCO (Đồng Tháp), có 3 sản phẩm thương mại Doraval 80mg, Doraval plus 160/25mg, Oraval plus 80/12,5mg; CT cổ phần PYMEPHARCO (Phú Yên), có 4 sản phẩm Pyvasart hàm lượng 40,80,160mg và Pyvasart HCT 80/12.5mg; CT cổ phần dược phẩm Cửu Long (Vĩnh Long) có sản phẩm Valsartan 80mg; CT cổ phần dược phẩm TƯ 2 (Hà Nội), có sản phẩm Tolzartan Plus 160mg. Trong đó CT cổ phần dược phẩm Cửu Long báo cáo nhập 160kg valsartan của ZHP từ ngày 21.2 và đã dùng gần 50kg để sản xuất thuốc, tuy nhiên, toàn bộ số thuốc này đang lưu kho, chưa bán ra thị trường.
Video đang HOT
Đại diện Phòng Nghiệp vụ dược, Sở Y tế Hà Nội cho biết TP có 4 BV quận, huyện là Hà Đông, Đống Đa, Thanh Nhàn, Quốc Oai và 3 công ty dược trúng thầu một số thuốc trong danh mục thu hồi. Tuy nhiên, BV Đống Đa và Hà Đông đã cấp phát hết số thuốc nhận về; BV Thanh Nhàn trả lại nhà cung ứng gần 2.000 viên; BV huyện Quốc Oai chưa nhập thuốc; thu hồi được ở ba CT dược khác khoảng 136.000 viên thuốc chứa valsartan…. Cùng với thông báo đình chỉ 23 loại thuốc nói trên, Cục Quản lý dược công bố thêm danh sách 14 loại thuốc chứa Valsartan khác, xuất xứ Hàn Quốc, Bangladesh, Pakistan, Ấn Độ… phải tạm ngừng nhập khẩu, lưu hành, sử dụng do chưa có báo cáo về nguồn gốc nguyên liệu… Ngày 6.8, Bộ An toàn thực phẩm và dược phẩm Hàn Quốc cấm 22 hãng dược phẩm của nước này bán 59 sản phẩm do CT Daebong LS sản xuất vì chứa valsartan; cấm Daebong LS điều chế và bán hoạt chất valsartan. Quyết định này được đưa ra sau khi một số loại valsartan do Daebong LS sản xuất được xác nhận chứa NDMA mà Cơ quan nghiên cứu ung thư thuộc Tổ chức Y tế thế giới xếp vào danh mục các chất gây ung thư. Daebong LS nhập valsartan thô từ hãng dược phẩm Zhuhai Rundu Mintong Pharmaceutical, Trung Quốc để điều chế valsartan tinh chất… Ở Trung Quốc, 5/6 CT dược sử dụng valsartan của ZHP đã thu hồi sản phẩm, CT còn lại khẳng định chưa xuất hàng và đã trả lại toàn bộ nguyên liệu. Đã có 22 quốc gia trong đó có Việt Nam, Anh, Mỹ, Đức, Canada, Pháp, Thụy Điển… thu hồi 2.300 lô thuốc Valsartan do ZHP sản xuất từ đầu tháng 7.2018.
Dùng để điều trị cao huyết áp và phòng suy tim, valsartan được công ty Novartis, Thụy Sĩ điều chế đầu tiên, từ những năm 1980 với tên thương mại là Diovan. Sau khi thuốc hết hạn bảo hộ độc quyền sở hữu công nghiệp, .nhiều hãng dược khác cũng điều chế Valsartan, trong đó có Hoa Hải (thành lập năm 1989). Không chỉ vươn lên thành nhà sản xuất valsartan hàng đầu thế giới, ZHP còn là công ty dược Trung Quốc đầu tiên có sản phẩm được Mỹ chấp nhận. Theo báo cáo của EMA, từ năm 2012, valsartan của ZHP đã bị nghi ngờ chứa NDMA, nhiều khả năng do thay đổi quy trình sản xuất… EMA đã nghiên cứu để xem thời gian dùng và lượng NDMA như thế nào sẽ khiến bệnh nhân bị ung thư. Nghiên cứu trên động vật cho thấy NDMA gây ung thư gan, thận và đường hô hấp. NDMA không gây tác hại tức thì mà sau nhiều năm sử dụng liên tục.
Ngay cả Trung Quốc cũng cấm
Giới chức Trung Quốc đã kêu gọi các cơ sở y tế thu hồi và loại bỏ thuốc valsartan do ZHP sản xuất. Trên websie chính thức, Ủy ban Y tế Trung Quốc khuyến cáo BS và bệnh nhân không dùng thuốc này để điều trị bệnh. Động thái này diễn ra sau khi EMA phát hiện lô valsartan do ZHP điều chế chứa NDMA! Ông John Brito, chuyên gia của công ty nghiên cứu thị trường dược phẩm Fore Pharma nói rằng, quy mô thu hồi là rất lớn bởi valsartan do ZHP điều chế được bán khắp thế giới… Alex Jiang, nhà phân tích của ngân hàng đầu tư UOB Kay Hian thì cho rằng, bê bối của ZHP sẽ ảnh hưởng mạnh mẽ tới nỗ lực xuất khẩu thuốc suốt ba năm qua của Trung Quốc, nhất là khi scandal vacxin DTP (phòng bạch hầu, ho gà, uốn ván) kém chất lượng vừa “nổ” ra… Bà Rosemary Gibson, chuyên viên tư vấn thuộc trung tâm đạo đức sinh học The Hastings, Mỹ, nói: “Dược phẩm sản xuất tại Trung Quốc đang bị mất uy tín” và “Valsartan chứa chất độc khiến cộng đồng đặt ra câu hỏi liệu những sản phẩm made in China khác có đáp ứng tiêu chuẩn toàn cầu hay không”.
Ngày 30.7, công ty Hoa Hải tuyên bố, cam đoan mọi dược phẩm khác của họ không nhiễm NDMA và sẽ cải thiện hệ thống để ngăn chặn sự cố tương tự, vì ngoài thuốc tim mạch, họ còn sản xuất thuốc chống trầm cảm, điều trị dị ứng và chữa HIV… Tuy nhiên, còn phải chờ xem vì trước nay đã chứng kiến nhiều chuyện khác nhau giữa nói và làm. Hẳn nhiều người còn nhớ thập niên 90 TK trước, nhiều người Việt khốn khổ vì chó Trung Quốc bỗng “hóa” thành chó Nhật. Khi phục chế bài thuốc An cung ngưu hoàng hoàn từ đời Thanh, hiệu thuốc Đồng Nhân Đường ở Bắc Kinh ngày nay thay sừng Tê (vì không có) bằng sừng trâu nước, không có sỏi mật bò tót (ngưu hoàng) nên thay bằng sỏi mật bò nuôi. Năm 2016, chính báo điện tử Sina.com của Trung Quốc đăng bài “Lật tẩy Đông trùng Hạ thảo” vì có đến 570 loài Trùng – Thảo (biến đổi đông – hè) với cùng phương thức ký sinh như nhau và phân bố khắp Châu Á, Úc… Trong các dược điển cổ của các danh y nổi tiếng lịch sử Trung Quốc như “Bản thảo cương mục” (của danh y Lý Thời Trân (1513 – 1593), đời nhà Minh), “Trung dược tam bảo”, Đông trùng Hạ thảo chỉ được xếp ngang với nhân sâm về công dụng chữa bệnh; là thứ dược liệu tầm thường nhất, xếp hạng cuối. Tạng dược sư danh tiếng Thanh Mai Nhiên Đinh ở châu Ngọc Thụ, Tây Tạng – thủ phủ “Đông trùng Hạ thảo” nói: “Trùng Thảo thường chỉ có tác dụng dẫn thuốc thôi”. Trong số hàng trăm bài thuốc nhiều vị dùng ở Viện Tạng y tỉnh Thanh Hải, chỉ duy nhất một phương thuốc dạng tễ dùng để chữa bệnh phụ khoa sử dụng “Đông trùng Hạ thảo” mà thôi… Năm 1993, ở giải điền kinh quốc tế Stuttgart, Đức, Trung Quốc đoạt 12 huy chương vàng và trong năm đó các VĐV điền kinh Trung Quốc có thêm 66 kỷ lục Trung Quốc, Châu Á và thế giới, được cho là dùng “Tinh chất ba ba Trung Quốc” và “Đông trùng Hạ thảo” và tất nhiên, sau đó giá Đông trùng Hạ thảo tăng đến mức khó tin (đắt nhất khoảng 3,5 tỉ VNĐ/kg). Khi Mã Tuấn Nhân – huấn luyện viên đội tuyển chạy cự ly trung bình và dài của tỉnh Liêu Ninh bị điều tra và cáo buộc án doping thì thành tích của quân nhà Mã “biến mất” ở Olympic Sydney 2000 và cả “Tinh chất ba ba Trung Quốc” lẫn “Đông trùng Hạ thảo” cũng mất dạng trên các trang quảng cáo! Năm 2010, Viện Kiểm nghiệm thuốc TW và Bộ môn Y dược học cổ truyền – ĐH Y Hà Nội phối hợp kiểm tra 21 mẫu đông dược Phòng kỷ (tên khác: Hán phòng kỷ, Phấn phòng kỷ, Thạch thiềm thử, Rễ gió…, nhập từ Trung Quốc, Việt Nam không có cây thuốc này) thấy hàm lượng acid aristolochic 1 dao động từ 0,001 – 1,363mg/g. Cơ quan quản lý thuốc và thực phẩm Mỹ từ lâu đã cảnh báo không sử dụng các dược liệu và sản phẩm có các acid aristolochic 1 (độc hơn) và acid aristolochic 2, vì gây ung thư, biến đổi gene và suy thận. Bộ Y tế phải tức tốc ra lệnh đình chỉ sử dụng, thu hồi và tiêu hủy. Năm 2012, khi kiểm tra 400 mẫu dược liệu nhập từ Trung Quốc, thấy 60% không đạt chất lượng theo dược điển Việt Nam; 20% vị thuốc có sự nhầm lẫn giữa các loại, có hóa chất độc hại, chất nhuộm màu và hàm lượng hoạt chất thấp. Đặc biệt, phát hiện 3 loại dược liệu bị làm giả là Bạch linh, Thỏ ti tử, Hồng hoa. Xét nghiệm thấy, Bạch linh có đến 80% canxi cabonat; Thỏ ti tử được trộn bằng xi măng; Hồng hoa chứa chất gây ung thư. Mục đích của việc trộn canxi cabonat để chống phát hiện làm giả (Bạch linh giả không trộn canxi cacbonat sẽ tan nhanh khi ngâm nước). Năm 2015, kiểm tra 227 mẫu dược liệu nhập từ nước này, có đến 60% không đạt hàm lượng hoạt chất và làm giả. Đặc biệt hai vị Huyết đằng, Khương hoạt đã bị chiết xuất hết hoạt chất.
BS VĂN BÌNH
Theo laodong.vn
Thu hồi 23 thuốc sản xuất từ nguyên liệu của Trung Quốc
Cục Quản lý Dược vừa có văn bản hỏa tốc gửi Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, các cơ sở kinh doanh thuốc về việc đình chỉ 23 loại thuốc thành phẩm được sản xuất từ nguyên liệu Valsartan do công ty Zhejiang Huahai Pharmaceutical - Trung Quốc sản xuất.
Theo thông báo của Cơ quan quản lý dược phẩm châu Âu (EMA), Cơ quan quản lý dược Canada và một số cơ quan quản lý dược khác, các thuốc chứa Valsartan được sản xuất từ nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical-Trung Quốc sản xuất buộc phải thu hồi. Nguyên nhân là do nguyên liệu này chứa tạp chất N-nitrosodimethylamine (NDMA) có nguy cơ gây ung thư.
Để đảm bảo an toàn cho người sử dụng, ngày 10/7, Cục Quản lý Dược thông báo cho sở y tế các tỉnh, thành phố trực thuộc Trung ương, các cơ sở sản xuất, kinh doanh thuốc về việc đình chỉ lưu hành tất cả các thuốc thành phẩm được sản xuất từ nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical-Trung Quốc sản xuất theo danh mục sau:
Cục yêu cầu các công ty đăng ký thuốc, sản xuất thuốc, công ty nhập khẩu cần phối hợp với các nhà phân phối thuốc thông báo thu hồi tất cả các lô thuốc thành phẩm trong công thức sản xuất có chứa nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical-Trung Quốc sản xuất theo danh mục kèm theo tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc.
Đồng thời, Cục yêu cầu ngừng ngay việc sử dụng nguyên liệu này để sản xuất thuốc thành phẩm; thực hiện đánh giá nhà cung cấp, kiểm tra, nghiên cứu sử dụng nguyên liệu Valsartan của nhà sản xuất mới nhằm đảm bảo yêu cầu về chất lượng, an toàn cho người sử dụng và thực hiện thủ tục thay đổi hồ sơ đăng ký thuốc theo đúng quy định của pháp luật.
Các công ty gửi báo cáo thu hồi (về số lượng xuất xưởng, số lượng thu hồi và các bằng chứng về việc thực hiện thu hồi tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc theo quy định của Bộ Y tế) Cục Quản lý Dược trong vòng 1 tháng (đến 10/8/2018).
Sở Y tế các tỉnh, thành phố thông báo việc thu hồi tới các cơ sở kinh doanh, sử dụng thuốc trên địa bàn; công bố thông tin việc thu hồi tất cả các thuốc thành phẩm được sản xuất từ nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical-Trung Quốc sản xuất trên trang thông tin điện tử của Sở.
Đồng thời, Sở Y tế kiểm tra và giám sát các công ty kinh doanh trên địa bàn thực hiện việc thu hồi các lô thuốc nêu trên, xử lý các đơn vị vi phạm theo quy định.
Trần Phương
Theo Dân trí
Bộ Y tế thông tin về việc thu hồi thuốc sử dụng nguyên liệu của Trung Quốc 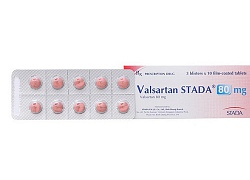 Ngày 25/7, Bộ Y tế thông tin, tại Việt Nam cơ quan này đã cấp phép lưu hành cho 111 thuốc chứa hoạt chất valsartan (điều trị cao huyết áp, suy tim và sau nhồi máu cơ tim), trong đó chỉ 23 thuốc sử dụng nguyên liệu do Trung Quốc sản xuất và phải thu hồi. Trước đó, ngày 18/07/2018, Tổ chức Y...
Ngày 25/7, Bộ Y tế thông tin, tại Việt Nam cơ quan này đã cấp phép lưu hành cho 111 thuốc chứa hoạt chất valsartan (điều trị cao huyết áp, suy tim và sau nhồi máu cơ tim), trong đó chỉ 23 thuốc sử dụng nguyên liệu do Trung Quốc sản xuất và phải thu hồi. Trước đó, ngày 18/07/2018, Tổ chức Y...
 Hiện trường vụ 3 người trong một nhà bị sát hại ở Đắk Lắk01:14
Hiện trường vụ 3 người trong một nhà bị sát hại ở Đắk Lắk01:14 Người gốc Việt nổ súng ngăn vụ cướp tiệm vàng ở California01:48
Người gốc Việt nổ súng ngăn vụ cướp tiệm vàng ở California01:48 Chân dung nghi phạm 22 tuổi ám sát đồng minh của Tổng thống Mỹ Donald Trump03:08
Chân dung nghi phạm 22 tuổi ám sát đồng minh của Tổng thống Mỹ Donald Trump03:08 Chủ 'Nha khoa Tuyết Chinh' bị bắt khẩn cấp, đình chỉ lập tức cơ sở hoạt động02:32
Chủ 'Nha khoa Tuyết Chinh' bị bắt khẩn cấp, đình chỉ lập tức cơ sở hoạt động02:32 Phó Tổng thống Mỹ khiêng quan tài của nhà hoạt động bị ám sát01:40
Phó Tổng thống Mỹ khiêng quan tài của nhà hoạt động bị ám sát01:40 Vụ thảm án ở Đắk Lắk: Bé trai thoát chết nhờ trèo qua tường, trên người nhiều vết dao đâm08:05
Vụ thảm án ở Đắk Lắk: Bé trai thoát chết nhờ trèo qua tường, trên người nhiều vết dao đâm08:05 Bắt khẩn cấp ba nam thanh niên 17-18 tuổi chuyên giật bàn bày đồ cúng ở TPHCM01:42
Bắt khẩn cấp ba nam thanh niên 17-18 tuổi chuyên giật bàn bày đồ cúng ở TPHCM01:42 Bắt khẩn cấp tài xế taxi 'chặt chém' người phụ nữ nghèo, kết cục không thể tránh03:04
Bắt khẩn cấp tài xế taxi 'chặt chém' người phụ nữ nghèo, kết cục không thể tránh03:04 Sức khỏe 2 anh em bị hành hung khi giúp người đi đường gặp nạn giờ ra sao?01:44
Sức khỏe 2 anh em bị hành hung khi giúp người đi đường gặp nạn giờ ra sao?01:44 Trẻ chơi trong hố cát ngập nước suýt bị chôn vùi, được người đi biển cứu01:56
Trẻ chơi trong hố cát ngập nước suýt bị chôn vùi, được người đi biển cứu01:56 Bí ẩn "vật thể lạ" trên Google Maps, nghi UFO ở Nam Cực, khiến thế giới sửng sốt02:33
Bí ẩn "vật thể lạ" trên Google Maps, nghi UFO ở Nam Cực, khiến thế giới sửng sốt02:33Tiêu điểm
Tin đang nóng
Tin mới nhất
Phát hoảng trong tai bé 14 tháng tuổi có dòi còn sống
Đã có 58 ca tử vong vì bệnh dại, cần biết 6 khuyến cáo phòng chống bệnh này của Bộ Y tế

Chế độ ăn Địa Trung Hải - 'Vũ khí' tự nhiên chống lại bệnh tiểu đường type 2

Cứu sống trẻ mắc bệnh Whitmore nguy hiểm

Cứu sống kịp thời bệnh nhân bị thuyên tắc phổi ở Cà Mau

Nghiên cứu trên nửa triệu người hé lộ tác dụng của leo cầu thang 2 phút mỗi ngày
Phụ nữ bị u xơ tử cung: Cần biết điều này để tốt cho tử cung và an toàn cho sức khỏe

Nhiễm nấm nội tạng đe dọa sức khỏe người già

Té ngã và co giật, nam sinh 16 tuổi mắc động kinh khởi phát cục bộ

7 loại đồ uống vào buổi tối giúp thư giãn và hỗ trợ giảm cholesterol xấu

Yếu tố ảnh hưởng đến nguồn sữa mẹ và cách tạo nguồn sữa dồi dào cho trẻ bú

Uống nhầm chai thuốc cai nghiện của cháu, cụ bà 79 tuổi hôn mê sâu
Có thể bạn quan tâm

Cựu Hoa hậu từng có mối tình đau khổ với Thành Long, bị con gái từ mặt
Sao châu á
13:37:03 17/09/2025
Thống đốc mới của Fed là người Tổng thống Trump đề cử
Thế giới
13:33:44 17/09/2025
Bác sĩ nói về tình trạng nghệ sĩ Huỳnh Anh Tuấn sau đột quỵ
Sao việt
13:25:16 17/09/2025
Vụ cháy 4 người chết: Hà Nội truy trách nhiệm cá nhân, tổ chức liên quan
Tin nổi bật
13:21:02 17/09/2025
Áo thun trắng hoàn hảo luôn hiện hữu trong mùa thu này
Thời trang
13:10:06 17/09/2025
4 thực phẩm lành mạnh giúp tăng cường sản xuất collagen tự nhiên
Làm đẹp
13:05:53 17/09/2025
Đỉnh nóc kịch trần là đây: Bom tấn Hàn cực hay quy tụ toàn sao hạng S, nhìn thôi đã thấy tiền bay phấp phới
Hậu trường phim
13:05:15 17/09/2025
Hai kẻ gây ra 3 vụ cướp giật tài sản hơn 300 triệu đồng ở Tây Ninh
Pháp luật
13:03:51 17/09/2025
"Crush quốc dân" một thời giờ mặt mũi biến dạng xuống cấp khó tin
Sao âu mỹ
12:52:47 17/09/2025
Người giàu có 5 quy tắc phong thủy: Nhà lúc nào cũng như kho bạc, tiền đầy đến mức chẳng biết tiêu sao cho hết
Sáng tạo
12:19:46 17/09/2025
 Bệnh ung thư phổi mà diễn viên Mai Phương mắc: Không phải đường cùng
Bệnh ung thư phổi mà diễn viên Mai Phương mắc: Không phải đường cùng Không phải trẻ sơ sinh khóc là quấy với hư đâu, tiếng khóc của bé còn mang lại lợi ích không ngờ
Không phải trẻ sơ sinh khóc là quấy với hư đâu, tiếng khóc của bé còn mang lại lợi ích không ngờ

 Vợ chồng trẻ qua đời do ung thư gan, chỉ vì thường xuyên sử dụng loại dầu ăn này
Vợ chồng trẻ qua đời do ung thư gan, chỉ vì thường xuyên sử dụng loại dầu ăn này Uống nước hoa quả trong chai lọ nhựa, Inox ung thư có ngày!
Uống nước hoa quả trong chai lọ nhựa, Inox ung thư có ngày! Những thực phẩm bảo vệ tim mạch, đừng để quá muộn mới biết đến
Những thực phẩm bảo vệ tim mạch, đừng để quá muộn mới biết đến Loại đồ uống này giúp đào thải chất gây ung thư cực tốt
Loại đồ uống này giúp đào thải chất gây ung thư cực tốt 6 bộ phận trên con gà dù thèm đến mấy cũng đừng có ăn
6 bộ phận trên con gà dù thèm đến mấy cũng đừng có ăn 10 vật dụng quen thuộc trong nhà ẩn chứa "chất độc" gây ung thư mà bạn cần cảnh giác
10 vật dụng quen thuộc trong nhà ẩn chứa "chất độc" gây ung thư mà bạn cần cảnh giác Ca đầu tiên ở Việt Nam chữa ung thư máu bằng liệu pháp đắt đỏ
Ca đầu tiên ở Việt Nam chữa ung thư máu bằng liệu pháp đắt đỏ 7 mẹo ăn uống giúp tuổi già khỏe mạnh, kéo dài tuổi thọ
7 mẹo ăn uống giúp tuổi già khỏe mạnh, kéo dài tuổi thọ Nga không tuyên bố vaccine ung thư Enteromix sẵn sàng sử dụng
Nga không tuyên bố vaccine ung thư Enteromix sẵn sàng sử dụng Chuyên gia giải thích hiện tượng cười khi ngủ
Chuyên gia giải thích hiện tượng cười khi ngủ Hình ảnh ruột thừa vỡ mủn nát khiến bác sĩ sốc
Hình ảnh ruột thừa vỡ mủn nát khiến bác sĩ sốc Có phải càng đổ nhiều mồ hôi nhiều khi luyện tập càng đốt mỡ nhiều?
Có phải càng đổ nhiều mồ hôi nhiều khi luyện tập càng đốt mỡ nhiều? Thêm 2 thứ này giúp nước mía thành "thuốc quý" giải độc gan
Thêm 2 thứ này giúp nước mía thành "thuốc quý" giải độc gan Ăn khoai lang cần tránh kết hợp với những thực phẩm này
Ăn khoai lang cần tránh kết hợp với những thực phẩm này Hi hữu: Xây nhầm nhà trên đất của người khác rồi đề nghị... mua lại đất
Hi hữu: Xây nhầm nhà trên đất của người khác rồi đề nghị... mua lại đất Ra mắt nhà bạn trai sắp cưới, thấy anh chồng tương lai, tôi bủn rủn buột miệng nói 5 từ khiến tất cả quay lại nhìn với ánh mắt đáng sợ
Ra mắt nhà bạn trai sắp cưới, thấy anh chồng tương lai, tôi bủn rủn buột miệng nói 5 từ khiến tất cả quay lại nhìn với ánh mắt đáng sợ Cha đẻ hit quốc dân 6,5 tỷ view tiết lộ sự thật về ca khúc vận vào đời của cố nghệ sĩ Mai Phương
Cha đẻ hit quốc dân 6,5 tỷ view tiết lộ sự thật về ca khúc vận vào đời của cố nghệ sĩ Mai Phương Vụ án chấn động Hollywood: Minh tinh màn bạc bị nghi giết tình nhân và để con gái 14 tuổi gánh tội
Vụ án chấn động Hollywood: Minh tinh màn bạc bị nghi giết tình nhân và để con gái 14 tuổi gánh tội Nguyên nhân qua đời của nam diễn viên Vu Mông Lung
Nguyên nhân qua đời của nam diễn viên Vu Mông Lung Chàng trai ở TPHCM nuôi hàng trăm đàn kiến làm thú cưng suốt 6 năm
Chàng trai ở TPHCM nuôi hàng trăm đàn kiến làm thú cưng suốt 6 năm 5 cô gái Việt là "nhân chứng" cho sự thay đổi cuộc sống nhờ "dao kéo": Đẹp, giàu, bản sao Phạm Băng Băng
5 cô gái Việt là "nhân chứng" cho sự thay đổi cuộc sống nhờ "dao kéo": Đẹp, giàu, bản sao Phạm Băng Băng Khi vợ bỗng trở thành 'người thứ ba': Sự thật cay đắng được vạch trần sau 12 năm chung sống
Khi vợ bỗng trở thành 'người thứ ba': Sự thật cay đắng được vạch trần sau 12 năm chung sống
 Nữ diễn viên viên "Tân dòng sông ly biệt" qua đời
Nữ diễn viên viên "Tân dòng sông ly biệt" qua đời Drama căng nhất lúc này: Cát Phượng công khai chê bai phim mình đóng, đạo diễn đáp trả bằng 1 từ quá gắt
Drama căng nhất lúc này: Cát Phượng công khai chê bai phim mình đóng, đạo diễn đáp trả bằng 1 từ quá gắt Sau tiếng la thất thanh, phát hiện 2 vợ chồng tử vong trước cửa nhà
Sau tiếng la thất thanh, phát hiện 2 vợ chồng tử vong trước cửa nhà Vụ chồng bị phạt tù vì quan hệ với vợ: Tòa không chấp nhận hoãn thi hành án
Vụ chồng bị phạt tù vì quan hệ với vợ: Tòa không chấp nhận hoãn thi hành án Tình tiết mới vụ "mỹ nam Trung Quốc" ngã lầu tử vong: 17 người uống hết 38 chai, 8 nghi phạm đã "lên đồn" nhưng có người nói dối?
Tình tiết mới vụ "mỹ nam Trung Quốc" ngã lầu tử vong: 17 người uống hết 38 chai, 8 nghi phạm đã "lên đồn" nhưng có người nói dối? "Nữ thần thanh xuân" bị tố hãm hại mỹ nam Vu Mông Lung
"Nữ thần thanh xuân" bị tố hãm hại mỹ nam Vu Mông Lung Cặp đôi ngôn tình trục trặc vì nhà trai lén "ăn chả ăn nem" nhiều lần, nữ hoàng rating tuyên bố đổ vỡ hôn nhân?
Cặp đôi ngôn tình trục trặc vì nhà trai lén "ăn chả ăn nem" nhiều lần, nữ hoàng rating tuyên bố đổ vỡ hôn nhân? Hội nghệ sĩ đã "căng", đòi làm rõ cái chết gây sốc của nam diễn viên đẹp hơn cả Dương Mịch
Hội nghệ sĩ đã "căng", đòi làm rõ cái chết gây sốc của nam diễn viên đẹp hơn cả Dương Mịch Nam chính Mưa Đỏ lần đầu chạm mặt người yêu cũ tại sự kiện, lộ thái độ khiến cả cõi mạng tiếc đứt ruột
Nam chính Mưa Đỏ lần đầu chạm mặt người yêu cũ tại sự kiện, lộ thái độ khiến cả cõi mạng tiếc đứt ruột