Thu hồi thuốc cao huyết áp nghi gây ung thư
Chi nhánh tại Nhật của Pfizer, một hãng dược đa quốc gia ở Mỹ với doanh thu thuần năm 2017 là 21 tỷ USD, vừa thu hồi một loại thuốc cao huyết áp do tìm thấy chất gây ung thư trong thành phần hoạt tính Valsartan của thuốc, theo Reuters ngày 9/2.
Các loại thuốc Valsartan liên quan đến nhóm thuốc cao huyết áp phổ rộng bán khá chạy thời gian gần đây
Cụ thể, đối tượng thu hồi là 763.000 viên Amvalo sản xuất từ tháng 4-7/2018 tại Mylan Laoboratories Limited ở Ấn Độ, Pfizer Inc tại Nhật Bản bố cáo đồng thời trấn an rằng chưa ghi nhận được vấn đề sức khoẻ nào từ người tiêu dùng.
Trước đó không lâu, ngày 20/1, một công ty dược khác ở Mỹ là Prinston Pharmaceuticals cũng phải thu hồi tám lô thuốc cao huyết áp Irbesartan vì hiềm nghi tạp chất ung thư, cụ thể là một lô Irbesartan và bảy lô Irbesartan HCTZ thuốc viên. Các lô thuốc này chứa hàm lượng chất gây ung thư nitrosodiethylamine (NDEA) vượt quá mức cho phép, công ty thừa nhận như vậy.
Các thành phần của thuốc được sản xuất tại một nhà máy đặt ở Trung Quốc mang tên Zhejiang Huahai Pharmaceuticals (Triết Gian Hoa Hải Dược Phẩm), theo USA Today.
Thực ra, tháng 7/2018, Zhejiang Huahai Pharmaceuticals, cũng nói sẽ thu hồi Valsartan bán cho người tiêu dùng Mỹ sau khi phát hiện tạp chất gây ung thư.
Kể từ đó, Cơ quan Thuốc & Thực phẩm Mỹ (FDA) phát thư cảnh báo và yêu cầu hoãn nhập tất cả các lô thuốc sản xuất từ nhà máy này. Một nhà máy ở Ấn Độ mang tên Hetero Labs Limited cũng bị liên đới về vụ thu hồi.
Cả Irbesartan lẫn Valsartan, và thành phần phổ biến khác là losartan, đều liên quan đến nhóm thuốc cao huyết áp phổ rộng bán khá chạy thời gian gần đây. Chúng được gọi là các chất ngăn chặn thụ thể kích thích tố tăng huyết áp.
Video đang HOT
Tháng 11 năm ngoái, Pfizer NV – nhà sản xuất biệt dược và thuốc gốc toàn cầu đăng ký ở Hà Lan, nói họ sẽ thu hồi một số vỉ thuốc cao huyết áp Valsartan ở Mỹ cũng chỉ vì phát hiện chúng chứa tạp chất có nguy cơ gây ung thư.
Tuy nhiên các công ty, trong đó có Prinston, khuyến cáo bệnh nhân nên tham vấn bác sỹ trước khi dừng dùng thuốc nằm trong diện thu hồi. Họ cho rằng không dùng thuốc bị thu hồi còn nguy hiểm hơn là tiếp tục dùng.
Bộ Y tế Nhật Bản yêu cầu các hãng dược ở nước này kiểm tra xem có thuốc nào dùng Valsartan hay Irbesartan chứa bất kỳ tạp chất gây ung thư nào không.
Prinston cho biết các loại thuốc irbesartan và irbesartan hydrochlorothiazide sau đây đều bị thu hồi:
Irbesartan, 300 mg, 90 count, lot number 331B18009, expires February 2021 (hạn sử dụng tháng 2/2021)
Irbesartan HCTZ, 300 mg/12.5 mg, 30 count, lot number 327A18001, expires March 2021 (hạn sử dụng tháng 3/2021)
Irbesartan HCTZ, 300 mg/12.5 mg, lot number 327A18002, expires March 2021( hạn sử dụng tháng 3/2021)
Irbesartan HCTZ, 300 mg/12.5 mg, 90 count, lot number 327B18008, expires March 2021 (hạn sử dụng tháng 3/2021)
Irbesartan HCTZ, 300 mg/12.5 mg, 90 count, lot number 327B18009, expires March 2021 (hạn sử dụng tháng 3/2021)
Irbesartan HCTZ, 150 mg/12.5mg 30 count, lot number 325D18004, expires March 2021 (hạn sử dụng tháng 3/2021)
Irbesartan HCTZ, 150 mg/12.5 mg, 90 count, lot number 325B18004, expires March 2021 (hạn sử dụng tháng 3/2021)
Irbesartan HCTZ, 150 mg /12.5 mg, 30 count, lot number 325D18005, expires March 2021 (hạn sử dụng tháng 3/2021)
HOÀNG QUỐC DŨNG
Theo Reuters, US Today
Thực hư chuyện thuốc chứa Valsartan gây ung thư
Hơn một tháng qua, dư luận ồn ào vì 22 quốc gia đồng loạt cấm thuốc Trung Quốc chứa chất valsartan, hoặc những thuốc bào chế trong nước mình nhập nguyên liệu valsartan có xuất xứ từ Trung Quốc.
Valsartan là nguyên liệu dùng để sản xuất thuốc điều trị cao huyết áp, suy tim. Thông tin thuốc này chứa chất gây ung thư khiến cho rất nhiều bệnh nhân lo lắng (ảnh minh họa)
Đầu tháng 7, Cơ quan quản lý dược phẩm Châu Âu (EMA), Canada và một số nước khác đã thu hồi các thuốc có thành phần valsartan do công ty (CT) Zhejiang Huahai Pharmaceutical (ZHP hay Hoa Hải), ở Chiết Giang, Trung Quốc cung cấp vì chứa chất N - nitrosodimethylamine (NDMA) gây ung thư. EMA đã đình chỉ lưu hành, thu hồi 23 loại thuốc trên thị trường có chứa hoạt chất NDMA. Sau Châu Âu và Canada, đến Mỹ thu hồi sản phẩm này. Ngày 13.7, Cục Quản lý dược Việt Nam thông báo thu hồi 23 loại thuốc chứa chất valsartan có nguồn gốc từ CT Hoa Hải, được xác định chứa NDMA, trong đó 9 loại do các CT dược nhập valsartan từ Hoa Hải về bào chế trong nước và 14 loại thành phẩm nhập từ Ấn Độ, Bangladesh, Ba Lan, Tây Ban Nha, Pakistan, Bungari... mà các nước này cũng dùng nguyên liệu valsartan của Hoa Hải. Còn lại 88 loại thuốc chứa valtarsan nhưng nguồn gốc nguyên liệu không phải từ ZHP vẫn được phép lưu hành.
Bị thu hồi trên diện rộng
Theo rà soát của Cục Quản lý dược, 23 loại thuốc trên có ở 8 CT được đăng ký, trong đó có 4 CT đang niêm yết trên thị trường chứng khoán là: CT cổ phần nhập khẩu y tế DOMESCO (Đồng Tháp), có 3 sản phẩm thương mại Doraval 80mg, Doraval plus 160/25mg, Oraval plus 80/12,5mg; CT cổ phần PYMEPHARCO (Phú Yên), có 4 sản phẩm Pyvasart hàm lượng 40,80,160mg và Pyvasart HCT 80/12.5mg; CT cổ phần dược phẩm Cửu Long (Vĩnh Long) có sản phẩm Valsartan 80mg; CT cổ phần dược phẩm TƯ 2 (Hà Nội), có sản phẩm Tolzartan Plus 160mg. Trong đó CT cổ phần dược phẩm Cửu Long báo cáo nhập 160kg valsartan của ZHP từ ngày 21.2 và đã dùng gần 50kg để sản xuất thuốc, tuy nhiên, toàn bộ số thuốc này đang lưu kho, chưa bán ra thị trường.
Đại diện Phòng Nghiệp vụ dược, Sở Y tế Hà Nội cho biết TP có 4 BV quận, huyện là Hà Đông, Đống Đa, Thanh Nhàn, Quốc Oai và 3 công ty dược trúng thầu một số thuốc trong danh mục thu hồi. Tuy nhiên, BV Đống Đa và Hà Đông đã cấp phát hết số thuốc nhận về; BV Thanh Nhàn trả lại nhà cung ứng gần 2.000 viên; BV huyện Quốc Oai chưa nhập thuốc; thu hồi được ở ba CT dược khác khoảng 136.000 viên thuốc chứa valsartan.... Cùng với thông báo đình chỉ 23 loại thuốc nói trên, Cục Quản lý dược công bố thêm danh sách 14 loại thuốc chứa Valsartan khác, xuất xứ Hàn Quốc, Bangladesh, Pakistan, Ấn Độ... phải tạm ngừng nhập khẩu, lưu hành, sử dụng do chưa có báo cáo về nguồn gốc nguyên liệu... Ngày 6.8, Bộ An toàn thực phẩm và dược phẩm Hàn Quốc cấm 22 hãng dược phẩm của nước này bán 59 sản phẩm do CT Daebong LS sản xuất vì chứa valsartan; cấm Daebong LS điều chế và bán hoạt chất valsartan. Quyết định này được đưa ra sau khi một số loại valsartan do Daebong LS sản xuất được xác nhận chứa NDMA mà Cơ quan nghiên cứu ung thư thuộc Tổ chức Y tế thế giới xếp vào danh mục các chất gây ung thư. Daebong LS nhập valsartan thô từ hãng dược phẩm Zhuhai Rundu Mintong Pharmaceutical, Trung Quốc để điều chế valsartan tinh chất... Ở Trung Quốc, 5/6 CT dược sử dụng valsartan của ZHP đã thu hồi sản phẩm, CT còn lại khẳng định chưa xuất hàng và đã trả lại toàn bộ nguyên liệu. Đã có 22 quốc gia trong đó có Việt Nam, Anh, Mỹ, Đức, Canada, Pháp, Thụy Điển... thu hồi 2.300 lô thuốc Valsartan do ZHP sản xuất từ đầu tháng 7.2018.
Dùng để điều trị cao huyết áp và phòng suy tim, valsartan được công ty Novartis, Thụy Sĩ điều chế đầu tiên, từ những năm 1980 với tên thương mại là Diovan. Sau khi thuốc hết hạn bảo hộ độc quyền sở hữu công nghiệp, .nhiều hãng dược khác cũng điều chế Valsartan, trong đó có Hoa Hải (thành lập năm 1989). Không chỉ vươn lên thành nhà sản xuất valsartan hàng đầu thế giới, ZHP còn là công ty dược Trung Quốc đầu tiên có sản phẩm được Mỹ chấp nhận. Theo báo cáo của EMA, từ năm 2012, valsartan của ZHP đã bị nghi ngờ chứa NDMA, nhiều khả năng do thay đổi quy trình sản xuất... EMA đã nghiên cứu để xem thời gian dùng và lượng NDMA như thế nào sẽ khiến bệnh nhân bị ung thư. Nghiên cứu trên động vật cho thấy NDMA gây ung thư gan, thận và đường hô hấp. NDMA không gây tác hại tức thì mà sau nhiều năm sử dụng liên tục.
Ngay cả Trung Quốc cũng cấm
Giới chức Trung Quốc đã kêu gọi các cơ sở y tế thu hồi và loại bỏ thuốc valsartan do ZHP sản xuất. Trên websie chính thức, Ủy ban Y tế Trung Quốc khuyến cáo BS và bệnh nhân không dùng thuốc này để điều trị bệnh. Động thái này diễn ra sau khi EMA phát hiện lô valsartan do ZHP điều chế chứa NDMA! Ông John Brito, chuyên gia của công ty nghiên cứu thị trường dược phẩm Fore Pharma nói rằng, quy mô thu hồi là rất lớn bởi valsartan do ZHP điều chế được bán khắp thế giới... Alex Jiang, nhà phân tích của ngân hàng đầu tư UOB Kay Hian thì cho rằng, bê bối của ZHP sẽ ảnh hưởng mạnh mẽ tới nỗ lực xuất khẩu thuốc suốt ba năm qua của Trung Quốc, nhất là khi scandal vacxin DTP (phòng bạch hầu, ho gà, uốn ván) kém chất lượng vừa "nổ" ra... Bà Rosemary Gibson, chuyên viên tư vấn thuộc trung tâm đạo đức sinh học The Hastings, Mỹ, nói: "Dược phẩm sản xuất tại Trung Quốc đang bị mất uy tín" và "Valsartan chứa chất độc khiến cộng đồng đặt ra câu hỏi liệu những sản phẩm made in China khác có đáp ứng tiêu chuẩn toàn cầu hay không".
Ngày 30.7, công ty Hoa Hải tuyên bố, cam đoan mọi dược phẩm khác của họ không nhiễm NDMA và sẽ cải thiện hệ thống để ngăn chặn sự cố tương tự, vì ngoài thuốc tim mạch, họ còn sản xuất thuốc chống trầm cảm, điều trị dị ứng và chữa HIV... Tuy nhiên, còn phải chờ xem vì trước nay đã chứng kiến nhiều chuyện khác nhau giữa nói và làm. Hẳn nhiều người còn nhớ thập niên 90 TK trước, nhiều người Việt khốn khổ vì chó Trung Quốc bỗng "hóa" thành chó Nhật. Khi phục chế bài thuốc An cung ngưu hoàng hoàn từ đời Thanh, hiệu thuốc Đồng Nhân Đường ở Bắc Kinh ngày nay thay sừng Tê (vì không có) bằng sừng trâu nước, không có sỏi mật bò tót (ngưu hoàng) nên thay bằng sỏi mật bò nuôi. Năm 2016, chính báo điện tử Sina.com của Trung Quốc đăng bài "Lật tẩy Đông trùng Hạ thảo" vì có đến 570 loài Trùng - Thảo (biến đổi đông - hè) với cùng phương thức ký sinh như nhau và phân bố khắp Châu Á, Úc... Trong các dược điển cổ của các danh y nổi tiếng lịch sử Trung Quốc như "Bản thảo cương mục" (của danh y Lý Thời Trân (1513 - 1593), đời nhà Minh), "Trung dược tam bảo", Đông trùng Hạ thảo chỉ được xếp ngang với nhân sâm về công dụng chữa bệnh; là thứ dược liệu tầm thường nhất, xếp hạng cuối. Tạng dược sư danh tiếng Thanh Mai Nhiên Đinh ở châu Ngọc Thụ, Tây Tạng - thủ phủ "Đông trùng Hạ thảo" nói: "Trùng Thảo thường chỉ có tác dụng dẫn thuốc thôi". Trong số hàng trăm bài thuốc nhiều vị dùng ở Viện Tạng y tỉnh Thanh Hải, chỉ duy nhất một phương thuốc dạng tễ dùng để chữa bệnh phụ khoa sử dụng "Đông trùng Hạ thảo" mà thôi... Năm 1993, ở giải điền kinh quốc tế Stuttgart, Đức, Trung Quốc đoạt 12 huy chương vàng và trong năm đó các VĐV điền kinh Trung Quốc có thêm 66 kỷ lục Trung Quốc, Châu Á và thế giới, được cho là dùng "Tinh chất ba ba Trung Quốc" và "Đông trùng Hạ thảo" và tất nhiên, sau đó giá Đông trùng Hạ thảo tăng đến mức khó tin (đắt nhất khoảng 3,5 tỉ VNĐ/kg). Khi Mã Tuấn Nhân - huấn luyện viên đội tuyển chạy cự ly trung bình và dài của tỉnh Liêu Ninh bị điều tra và cáo buộc án doping thì thành tích của quân nhà Mã "biến mất" ở Olympic Sydney 2000 và cả "Tinh chất ba ba Trung Quốc" lẫn "Đông trùng Hạ thảo" cũng mất dạng trên các trang quảng cáo! Năm 2010, Viện Kiểm nghiệm thuốc TW và Bộ môn Y dược học cổ truyền - ĐH Y Hà Nội phối hợp kiểm tra 21 mẫu đông dược Phòng kỷ (tên khác: Hán phòng kỷ, Phấn phòng kỷ, Thạch thiềm thử, Rễ gió..., nhập từ Trung Quốc, Việt Nam không có cây thuốc này) thấy hàm lượng acid aristolochic 1 dao động từ 0,001 - 1,363mg/g. Cơ quan quản lý thuốc và thực phẩm Mỹ từ lâu đã cảnh báo không sử dụng các dược liệu và sản phẩm có các acid aristolochic 1 (độc hơn) và acid aristolochic 2, vì gây ung thư, biến đổi gene và suy thận. Bộ Y tế phải tức tốc ra lệnh đình chỉ sử dụng, thu hồi và tiêu hủy. Năm 2012, khi kiểm tra 400 mẫu dược liệu nhập từ Trung Quốc, thấy 60% không đạt chất lượng theo dược điển Việt Nam; 20% vị thuốc có sự nhầm lẫn giữa các loại, có hóa chất độc hại, chất nhuộm màu và hàm lượng hoạt chất thấp. Đặc biệt, phát hiện 3 loại dược liệu bị làm giả là Bạch linh, Thỏ ti tử, Hồng hoa. Xét nghiệm thấy, Bạch linh có đến 80% canxi cabonat; Thỏ ti tử được trộn bằng xi măng; Hồng hoa chứa chất gây ung thư. Mục đích của việc trộn canxi cabonat để chống phát hiện làm giả (Bạch linh giả không trộn canxi cacbonat sẽ tan nhanh khi ngâm nước). Năm 2015, kiểm tra 227 mẫu dược liệu nhập từ nước này, có đến 60% không đạt hàm lượng hoạt chất và làm giả. Đặc biệt hai vị Huyết đằng, Khương hoạt đã bị chiết xuất hết hoạt chất.
BS VĂN BÌNH
Theo laodong.vn
Thu hồi, đình chỉ lưu hành loại thuốc chữa bệnh đường tiêu hóa  Cục Quản lý Dược (Bộ Y tế) vừa ra quyết định đình chỉ, thu hồi loại thuốc viên nén bao phim Peridom-M do Công ty Medopharm (India) sản xuất, Công ty cổ phần dược phẩm Tenamyd nhập khẩu do kết quả kiểm nghiệm không đạt chất lượng. Ảnh minh họa têuTrước đó, mẫu kiểm nghiệm thuốc viên nén bao phim Peridom-M (Domperidone maleate...
Cục Quản lý Dược (Bộ Y tế) vừa ra quyết định đình chỉ, thu hồi loại thuốc viên nén bao phim Peridom-M do Công ty Medopharm (India) sản xuất, Công ty cổ phần dược phẩm Tenamyd nhập khẩu do kết quả kiểm nghiệm không đạt chất lượng. Ảnh minh họa têuTrước đó, mẫu kiểm nghiệm thuốc viên nén bao phim Peridom-M (Domperidone maleate...
 Trung Quốc tung chatbot đấu ChatGPT, cổ phiếu Phố Wall chao đảo bốc hơi 1.000 tỉ14:53
Trung Quốc tung chatbot đấu ChatGPT, cổ phiếu Phố Wall chao đảo bốc hơi 1.000 tỉ14:53 Quán bún Hà Nội xin lỗi vụ bán 1,2 triệu đồng 3 bát bún riêu ngày Tết, nói chỉ là 'hiểu lầm'09:39
Quán bún Hà Nội xin lỗi vụ bán 1,2 triệu đồng 3 bát bún riêu ngày Tết, nói chỉ là 'hiểu lầm'09:39 Đường dây lừa đảo 13.000 người: Biệt danh ACE của 3 quản lý cấp cao02:36
Đường dây lừa đảo 13.000 người: Biệt danh ACE của 3 quản lý cấp cao02:36 Vụ xe ôtô lao xuống mương 7 người tử vong: Công an công bố nguyên nhân ban đầu14:39
Vụ xe ôtô lao xuống mương 7 người tử vong: Công an công bố nguyên nhân ban đầu14:39 11 'quái xế' chạy vào cao tốc Nghi Sơn - Diễn Châu bị phạt 78 triệu đồng501:27
11 'quái xế' chạy vào cao tốc Nghi Sơn - Diễn Châu bị phạt 78 triệu đồng501:27 Hé lộ kế hoạch mới của ông Trump về xung đột Nga-Ukraine08:31
Hé lộ kế hoạch mới của ông Trump về xung đột Nga-Ukraine08:31 Tổng thống Trump lên tiếng về 'thảm kịch' hàng không ở thủ đô Washington DC10:41
Tổng thống Trump lên tiếng về 'thảm kịch' hàng không ở thủ đô Washington DC10:41 'Chiến thắng' đầu tiên của Tổng thống Trump trong cuộc chiến trục xuất di dân lậu09:26
'Chiến thắng' đầu tiên của Tổng thống Trump trong cuộc chiến trục xuất di dân lậu09:26 Lãnh đạo nước ngoài đầu tiên được ông Trump mời đến Nhà Trắng08:45
Lãnh đạo nước ngoài đầu tiên được ông Trump mời đến Nhà Trắng08:45 Hàn Quốc sắp nhận trực thăng mới từ Mỹ để đối phó tàu ngầm Triều Tiên09:58
Hàn Quốc sắp nhận trực thăng mới từ Mỹ để đối phó tàu ngầm Triều Tiên09:58 Máy bay rơi gần trung tâm thương mại ở Mỹ, nhiều người thương vong03:42
Máy bay rơi gần trung tâm thương mại ở Mỹ, nhiều người thương vong03:42Tiêu điểm
Tin đang nóng
Tin mới nhất

Ăn thì là có tác dụng gì?
Cách cải thiện sức khỏe đường ruột

Ba không khi ăn hạt bí

Loại quả 'báu vật' ngày Tết, cực tốt cho sức khỏe nhiều người lại chỉ để ngắm
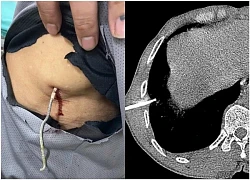
Người đàn ông bị dây kẽm dài 20cm xuyên vào lồng ngực

Dấu hiệu và cách xử trí ngộ độc rượu

Ăn uống đúng cách giúp phòng ngừa rối loạn tiêu hóa dịp Tết

Vì sao không nên uống thuốc với trà?

Những loại hạt nào được dùng trong ngày tết có dinh dưỡng cao?
8 ngày nghỉ Tết, hơn 24.000 người cấp cứu liên quan đến tai nạn giao thông

Chế độ dinh dưỡng, tập luyện hợp lý cho phụ nữ giảm cân dịp Tết

7 bài tập giảm đầy bụng, khó tiêu
Có thể bạn quan tâm

Bộ Tứ Báo Thủ bị chê dở nhất: Trấn Thành đăng đàn đáp trả gây xôn xao
Hậu trường phim
23:55:19 03/02/2025
'Sự ra đi của Từ Hy Viên là nỗi đau khắc sâu trong lòng chị'
Sao châu á
23:37:47 03/02/2025
Mỹ Tâm như nàng thơ bên hoa, ca sĩ Hoài Lâm tiều tụy
Sao việt
23:35:11 03/02/2025
Phim Việt hay đến mức được tăng 166% suất chiếu, cặp chính gây bão mạng vì ngọt từ phim đến đời
Phim việt
23:24:35 03/02/2025
Tổng kết Grammy 2025: Taylor Swift trắng tay, Beyoncé hoàn thành giấc mơ kèn vàng, một siêu sao "thắng đậm"
Nhạc quốc tế
23:18:28 03/02/2025
Bảo Anh gọi 1 Anh Trai là "thợ đụng", từng cùng tham gia band nhạc giao lưu Việt - Ấn rồi tan rã ngay lập tức
Nhạc việt
23:11:33 03/02/2025
Văn Hậu khoe ảnh chụp cùng nhà vợ toàn cực phẩm, mẹ Doãn Hải My gây chú ý với nhan sắc trẻ đẹp tuổi U50
Sao thể thao
22:35:09 03/02/2025
Cách chăm sóc, bảo vệ da trong mùa Xuân
Làm đẹp
22:17:45 03/02/2025
Mở cửa phòng trọ sau khi nghỉ Tết, các nam thanh nữ tú đua nhau khoe chùm ảnh "xem là phải bịt mũi"
Netizen
21:48:11 03/02/2025
Dò kim loại, 2 người đào được 'kho báu' quý giá
Lạ vui
20:02:46 03/02/2025
 Bác sĩ bàng hoàng chẩn đoán 2 chị em cùng bị u não hiếm gặp
Bác sĩ bàng hoàng chẩn đoán 2 chị em cùng bị u não hiếm gặp Những thực phẩm có hại cho hệ tiêu hóa
Những thực phẩm có hại cho hệ tiêu hóa
 Nhiều sản phẩm dinh dưỡng công thức nhiễm khuẩn Salmonella Poona đã được nhập khẩu về Việt Nam
Nhiều sản phẩm dinh dưỡng công thức nhiễm khuẩn Salmonella Poona đã được nhập khẩu về Việt Nam Những kiểu kết hợp thực phẩm dễ gây bệnh mà rất nhiều người mắc phải
Những kiểu kết hợp thực phẩm dễ gây bệnh mà rất nhiều người mắc phải Thu hồi 2 loại nước rửa tay không đạt chất lượng
Thu hồi 2 loại nước rửa tay không đạt chất lượng Thuốc huyết áp lại bị thu hồi do nhiễm chất gây ung thư
Thuốc huyết áp lại bị thu hồi do nhiễm chất gây ung thư Thu hồi kem dưỡng trắng da không đạt chất lượng
Thu hồi kem dưỡng trắng da không đạt chất lượng Amiăng thuộc nhóm một các chất gây ung thư cho người
Amiăng thuộc nhóm một các chất gây ung thư cho người Uống cà phê thường xuyên có hại hay lợi cho gan?
Uống cà phê thường xuyên có hại hay lợi cho gan? Rối loạn mỡ máu ở người cao tuổi nên ăn gì?
Rối loạn mỡ máu ở người cao tuổi nên ăn gì? Hai chị em nguy kịch sau khi uống lọ dung dịch màu hồng vứt ngoài ruộng
Hai chị em nguy kịch sau khi uống lọ dung dịch màu hồng vứt ngoài ruộng Uống bao nhiêu cốc bia khiến nồng độ cồn lên mức phạt kịch khung?
Uống bao nhiêu cốc bia khiến nồng độ cồn lên mức phạt kịch khung? Các bước đơn giản nhất để bắt đầu thiền định
Các bước đơn giản nhất để bắt đầu thiền định '3 nhiều, 1 giảm' cảnh báo bệnh tiểu đường
'3 nhiều, 1 giảm' cảnh báo bệnh tiểu đường Ăn hạt dẻ thường xuyên: 5 lợi ích 'vàng' cho sức khỏe
Ăn hạt dẻ thường xuyên: 5 lợi ích 'vàng' cho sức khỏe Phát hiện mới cải thiện hiệu quả điều trị cho bệnh nhân ung thư vú
Phát hiện mới cải thiện hiệu quả điều trị cho bệnh nhân ung thư vú Từ Hy Viên vừa qua đời: Chồng mới - chồng cũ lao vào cuộc chiến tranh chấp tài sản?
Từ Hy Viên vừa qua đời: Chồng mới - chồng cũ lao vào cuộc chiến tranh chấp tài sản? Mẹ khóc nghẹn bên thi thể Từ Hy Viên, cầu xin truyền thông và khán giả cùng làm 1 điều vì tâm nguyện của con
Mẹ khóc nghẹn bên thi thể Từ Hy Viên, cầu xin truyền thông và khán giả cùng làm 1 điều vì tâm nguyện của con Nhan sắc Doãn Hải My sau 10 ngày thẩm mỹ, khoe ảnh ở quê Đoàn Văn Hậu mà dân tình tấm tắc khen: Quá đẹp!
Nhan sắc Doãn Hải My sau 10 ngày thẩm mỹ, khoe ảnh ở quê Đoàn Văn Hậu mà dân tình tấm tắc khen: Quá đẹp! Nóng: Không tìm thấy chồng Từ Hy Viên
Nóng: Không tìm thấy chồng Từ Hy Viên Chồng cũ Từ Hy Viên về đến sân bay: Mắt sưng húp, còn làm 1 hành động gây bất ngờ
Chồng cũ Từ Hy Viên về đến sân bay: Mắt sưng húp, còn làm 1 hành động gây bất ngờ Hình ảnh mới của diva Hồng Nhung sau điều trị ung thư
Hình ảnh mới của diva Hồng Nhung sau điều trị ung thư Nhìn lại loạt khoảnh khắc visual xuất sắc của Từ Hy Viên trước khi mãi mãi ra đi ở tuổi 48 vì bệnh cúm
Nhìn lại loạt khoảnh khắc visual xuất sắc của Từ Hy Viên trước khi mãi mãi ra đi ở tuổi 48 vì bệnh cúm Ninh Bình: Bé trai bị bỏ rơi trong đêm lạnh mùng 4 Tết Nguyên đán kèm 1 khoản tiền
Ninh Bình: Bé trai bị bỏ rơi trong đêm lạnh mùng 4 Tết Nguyên đán kèm 1 khoản tiền Thi hài Từ Hy Viên được hỏa táng ở Nhật, di ngôn hé lộ tâm nguyện sau lần thập tử nhất sinh 9 năm trước
Thi hài Từ Hy Viên được hỏa táng ở Nhật, di ngôn hé lộ tâm nguyện sau lần thập tử nhất sinh 9 năm trước SỐC: Từ Hy Viên 3 lần cấp cứu vì nguy kịch ở Nhật, tử vong chỉ sau 5 ngày phát bệnh
SỐC: Từ Hy Viên 3 lần cấp cứu vì nguy kịch ở Nhật, tử vong chỉ sau 5 ngày phát bệnh Chấn động: Từ Hy Viên qua đời
Chấn động: Từ Hy Viên qua đời Đạo diễn Nguyễn Ngọc Quyền đột ngột qua đời ở tuổi 36, đồng nghiệp tiết lộ nguyên nhân
Đạo diễn Nguyễn Ngọc Quyền đột ngột qua đời ở tuổi 36, đồng nghiệp tiết lộ nguyên nhân Thêm 1 sao nam lên tiếng về drama chê phim Trấn Thành, đứng ra giảng hoà nhưng bị Lê Giang đáp trả đến câm nín
Thêm 1 sao nam lên tiếng về drama chê phim Trấn Thành, đứng ra giảng hoà nhưng bị Lê Giang đáp trả đến câm nín
 Chấn động vụ đánh ghen ngay tại rạp Việt dịp Tết, tình tiết y hệt phim Trấn Thành khiến 3,6 triệu người quá sốc
Chấn động vụ đánh ghen ngay tại rạp Việt dịp Tết, tình tiết y hệt phim Trấn Thành khiến 3,6 triệu người quá sốc Dòng tâm sự cuối cùng trên mạng xã hội của Từ Hy Viên trước khi qua đời
Dòng tâm sự cuối cùng trên mạng xã hội của Từ Hy Viên trước khi qua đời Vụ tai nạn 7 người tử vong ở Nam Định: Nữ tài xế đột ngột đánh lái sang phải
Vụ tai nạn 7 người tử vong ở Nam Định: Nữ tài xế đột ngột đánh lái sang phải