Thu hồi 23 thuốc sản xuất từ nguyên liệu của Trung Quốc
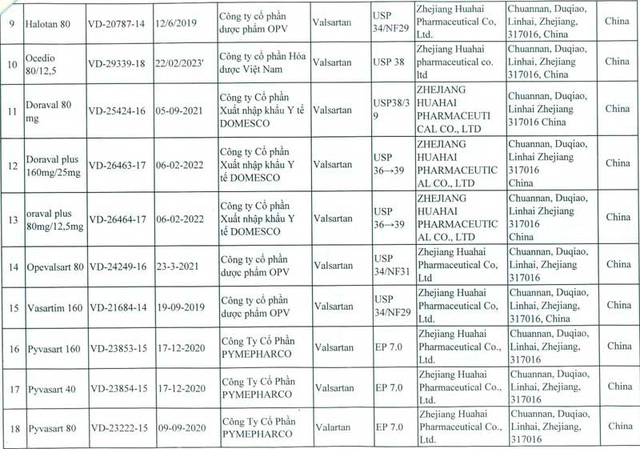
Cục Quản lý Dược vừa có văn bản hỏa tốc gửi Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, các cơ sở kinh doanh thuốc về việc đình chỉ 23 loại thuốc thành phẩm được sản xuất từ nguyên liệu Valsartan do công ty Zhejiang Huahai Pharmaceutical – Trung Quốc sản xuất.
Theo thông báo của Cơ quan quản lý dược phẩm châu Âu (EMA), Cơ quan quản lý dược Canada và một số cơ quan quản lý dược khác, các thuốc chứa Valsartan được sản xuất từ nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical-Trung Quốc sản xuất buộc phải thu hồi . Nguyên nhân là do nguyên liệu này chứa tạp chất N-nitrosodimethylamine (NDMA) có nguy cơ gây ung thư.
Để đảm bảo an toàn cho người sử dụng, ngày 10/7, Cục Quản lý Dược thông báo cho sở y tế các tỉnh, thành phố trực thuộc Trung ương, các cơ sở sản xuất, kinh doanh thuốc về việc đình chỉ lưu hành tất cả các thuốc thành phẩm được sản xuất từ nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical-Trung Quốc sản xuất theo danh mục sau:
Video đang HOT
Cục yêu cầu các công ty đăng ký thuốc, sản xuất thuốc , công ty nhập khẩu cần phối hợp với các nhà phân phối thuốc thông báo thu hồi tất cả các lô thuốc thành phẩm trong công thức sản xuất có chứa nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical-Trung Quốc sản xuất theo danh mục kèm theo tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc.
Đồng thời, Cục yêu cầu ngừng ngay việc sử dụng nguyên liệu này để sản xuất thuốc thành phẩm; thực hiện đánh giá nhà cung cấp, kiểm tra, nghiên cứu sử dụng nguyên liệu Valsartan của nhà sản xuất mới nhằm đảm bảo yêu cầu về chất lượng, an toàn cho người sử dụng và thực hiện thủ tục thay đổi hồ sơ đăng ký thuốc theo đúng quy định của pháp luật .
Các công ty gửi báo cáo thu hồi (về số lượng xuất xưởng, số lượng thu hồi và các bằng chứng về việc thực hiện thu hồi tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc theo quy định của Bộ Y tế) Cục Quản lý Dược trong vòng 1 tháng (đến 10/8/2018).
Sở Y tế các tỉnh, thành phố thông báo việc thu hồi tới các cơ sở kinh doanh, sử dụng thuốc trên địa bàn; công bố thông tin việc thu hồi tất cả các thuốc thành phẩm được sản xuất từ nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical-Trung Quốc sản xuất trên trang thông tin điện tử của Sở.
Đồng thời, Sở Y tế kiểm tra và giám sát các công ty kinh doanh trên địa bàn thực hiện việc thu hồi các lô thuốc nêu trên, xử lý các đơn vị vi phạm theo quy định.
Trần Phương
Theo Dân trí
4 công ty dược sản xuất thuốc kém chất lượng bị phạt tiền
Công ty Tipharco bị phạt nhiều nhất là 130 triệu đồng do sản xuất thuốc không đạt chất lượng, buôn bán nguyên liệu thuốc đã hết hạn.
Ảnh minh họa
Theo Cục Quản lý Dược (Bộ Y tế), từ tháng 3 đến nay đã phạt 4 công ty sản xuất thuốc không đạt tiêu chuẩn chất lượng, buộc thu hồi, tiêu hủy toàn bộ lô thuốc không đảm bảo chất lượng.
Cơ sở bị phạt tiền nhiều nhất là Công ty Cổ phần Dược phẩm Tipharco ở Tiền Giang. Công ty này sản xuất thuốc viên nén Prednisolon 5mg, số đăng ký VD-13888-11, số lô 010317, hạn dùng 4/3/2020 không đạt tiêu chuẩn chất lượng mức độ 3. Đơn vị này cũng buôn bán nguyên liệu làm thuốc Silymarin, số lô 20140912, hạn dùng 11/9/2017, đã hết hạn sử dụng.
Với hai sai phạm trên, Tipharco bị phạt 130 triệu đồng, tước quyền sử dụng giấy chứng nhận đủ điều kiện kinh doanh thuốc đối với nhập khẩu nguyên liệu làm thuốc trong 3 tháng.
Hai công ty khác cùng bị phạt 70 triệu đồng vì sản xuất thuốc không đạt yêu cầu chất lượng ở mức độ 2 là Công ty cổ phần Dược phẩm Trung ương 2 và Công ty cổ phần BV Pharma. Cả hai cũng bị tước quyền sử dụng giấy chứng nhận đủ điều kiện kinh doanh thuốc đối với phạm vi sản xuất loại thuốc vi phạm trong 3 tháng.
Cụ thể, Công ty cổ phần Dược phẩm Trung ương 2 (Hà Nội) sản xuất thuốc Seared 4200IU, SĐK: VD-21906-14, số lô 00316, ngày sản xuất 9/12/2016, hạn dùng 9/6/2018 không đạt yêu cầu chất lượng.
Công ty cổ phần BV Pharma (TP HCM) sản xuất thuốc Alphachymotrypsin BVP, SĐK: VD-13220-10, số lô 03B17, ngày sản xuất 27/2/2017, hạn dùng 27/2/2019 không đạt tiêu chuẩn chất lượng.
Ngoài ra Công ty cổ phần Dược Trung ương 3 (Đà Nẵng) cũng bị xử phạt 40 triệu đồng. Công ty này sản xuất thuốc Enalapril 10mg, SĐK:VD-15254-11, số lô 03/060818, không đạt yêu cầu chất lượng mức độ 3.
Phương Trang
Theo vnexpress.net
Thu hồi sản phẩm đặt âm đạo chưa được phép lưu hành  Sau khi thực hiện thanh tra đột xuất với việc thực hiện quy định của pháp luật trong sản xuất và kinh doanh sản phẩm Khang Mỹ Đơn, Thanh tra Bộ Y tế đã ra quyết định thu hồi sản phẩm này. Theo Quyết định số 106/QĐ-TTrB ký ngày 29/6, Chánh Thanh tra Bộ Y tế yêu cầu công ty TNHH VN Pharco...
Sau khi thực hiện thanh tra đột xuất với việc thực hiện quy định của pháp luật trong sản xuất và kinh doanh sản phẩm Khang Mỹ Đơn, Thanh tra Bộ Y tế đã ra quyết định thu hồi sản phẩm này. Theo Quyết định số 106/QĐ-TTrB ký ngày 29/6, Chánh Thanh tra Bộ Y tế yêu cầu công ty TNHH VN Pharco...
 Bắt khẩn cấp 4 đối tượng YouTuber ẩu đả, gây rối trật tự công cộng03:38
Bắt khẩn cấp 4 đối tượng YouTuber ẩu đả, gây rối trật tự công cộng03:38 Vụ 2 anh em làm việc tốt nghi bị đánh dã man ở Bắc Ninh: Camera ghi cảnh trước va chạm01:44
Vụ 2 anh em làm việc tốt nghi bị đánh dã man ở Bắc Ninh: Camera ghi cảnh trước va chạm01:44 Hơn 2 giờ truy bắt đối tượng sinh năm 1995 sát hại Thiếu tá công an01:08
Hơn 2 giờ truy bắt đối tượng sinh năm 1995 sát hại Thiếu tá công an01:08 Tập đoàn Chị Em Rọt mới chỉ hoàn tiền cho 6 khách hàng09:04
Tập đoàn Chị Em Rọt mới chỉ hoàn tiền cho 6 khách hàng09:04 Người trình báo mất 30 cây vàng khi ngủ trên ô tô là 'vua kickboxing Việt Nam'09:55
Người trình báo mất 30 cây vàng khi ngủ trên ô tô là 'vua kickboxing Việt Nam'09:55 Thông tin Chính phủ chính thức "điểm mặt" Độ Mixi, nội dung bài viết gây xôn xao02:43
Thông tin Chính phủ chính thức "điểm mặt" Độ Mixi, nội dung bài viết gây xôn xao02:43 Bồ Đào Nha tuyên bố quốc tang sau thảm kịch tàu điện00:59
Bồ Đào Nha tuyên bố quốc tang sau thảm kịch tàu điện00:59 Trung Đông chưa yên tiếng súng08:00
Trung Đông chưa yên tiếng súng08:00 Cựu Tổng thống Mỹ Biden phẫu thuật ung thư da09:16
Cựu Tổng thống Mỹ Biden phẫu thuật ung thư da09:16 Mr. Nawat công bố giá vé Miss Universe 2025, cao nhất 40 triệu đồng02:55
Mr. Nawat công bố giá vé Miss Universe 2025, cao nhất 40 triệu đồng02:55 Đường Lên Đỉnh Olympia bắt nguồn từ đâu, bí ẩn về tên gọi gây sốc?03:03
Đường Lên Đỉnh Olympia bắt nguồn từ đâu, bí ẩn về tên gọi gây sốc?03:03Tiêu điểm
Tin đang nóng
Tin mới nhất

Cúm mùa dễ gây biến chứng tim mạch, bác sĩ khuyến cáo tiêm vaccine hằng năm

Bị chó lạ cắn, người đàn ông ở Đắk Lắk tử vong

Bé gái tím tái, co giật vì uống nhầm thuốc chuột
Cúm A, bệnh 'quen mặt' nhưng không hề lành tính
Điều trị thành công ca bệnh trẻ bị hôn mê tăng áp lực thẩm thấu

Phát hiện chấn thương thận qua 3 dấu hiệu điển hình
Đi trên cỏ rậm rạp, nam thanh niên bị rắn hổ mang cắn
WHO đưa các thuốc ung thư và tiểu đường quan trọng vào danh sách thuốc thiết yếu

Can thiệp thành công cho bé gái 14 tuổi mắc tim bẩm sinh
Gắp thành công dị vật đâm thủng ruột non cho bệnh nhân

5 thời điểm không nên uống nước chè xanh

11 thực phẩm giàu sắt nên bổ sung vào chế độ ăn cho người thiếu máu do thiếu sắt
Có thể bạn quan tâm

Tùng Dương tiết lộ bí quyết để duy trì giọng hát tốt, "bắn" nốt cao liên tục: "Phải luôn chăm chỉ tập thể dục, sắp tới sẽ chơi thêm pickleball"
Nhạc việt
23:13:41 11/09/2025
1 Em Xinh bị cấm diễn concert?
Sao việt
22:59:41 11/09/2025
4 cặp đôi phim cổ trang Hoa ngữ được yêu thích năm 2025
Hậu trường phim
22:28:46 11/09/2025
Hiếp dâm thai phụ, bác sĩ ở Đồng Nai lĩnh án
Pháp luật
22:10:05 11/09/2025
Venezuela triển khai binh sĩ tới 284 "mặt trận chiến đấu" khắp cả nước
Thế giới
21:46:40 11/09/2025
Thế khó của streamer như Độ Mixi
Netizen
21:32:36 11/09/2025
Thương hiệu kinh dị 'trăm tỷ' của Thái Lan - 'Tee Yod: Quỷ ăn tạng' trở lại với phần 3, hứa hẹn kinh dị gấp 3!
Phim châu á
21:06:04 11/09/2025
Giông lốc mạnh, tôn bay như giấy trên đường ở TPHCM
Tin nổi bật
21:01:27 11/09/2025
Sao hạng A Hàn Quốc mất sự nghiệp vì tới Việt Nam, bị đối thủ vượt mặt hạ bệ mới sốc
Phim việt
20:42:18 11/09/2025
BTV Sơn Lâm thay NSND Xuân Bắc dẫn chương trình "Vua tiếng Việt" trên VTV
Tv show
20:30:20 11/09/2025
 Cà Mau: Dân “than” phải mua thuốc ngoài khi khám bảo hiểm y tế ở bệnh viện công
Cà Mau: Dân “than” phải mua thuốc ngoài khi khám bảo hiểm y tế ở bệnh viện công Lấy tạng hiến của tử tù: Sẽ phạm tội giết người
Lấy tạng hiến của tử tù: Sẽ phạm tội giết người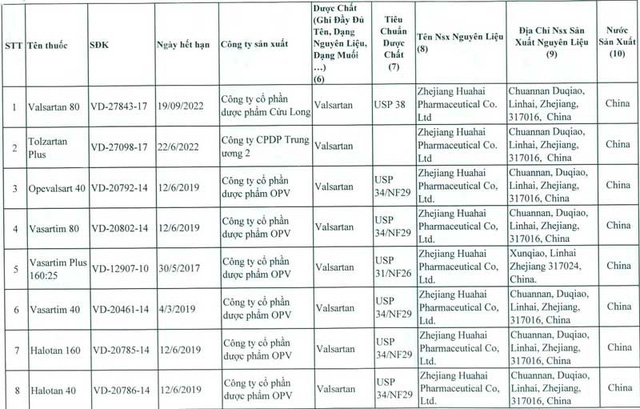


 "Đóng cửa" nhà hộ sinh ở Sóc Trăng sau sai phạm của lãnh đạo
"Đóng cửa" nhà hộ sinh ở Sóc Trăng sau sai phạm của lãnh đạo Thu hồi 1 loại thuốc điều trị phù nề sau chấn thương
Thu hồi 1 loại thuốc điều trị phù nề sau chấn thương Thu hồi 4 hóa mỹ phẩm do không đáp ứng quy định ghi nhãn
Thu hồi 4 hóa mỹ phẩm do không đáp ứng quy định ghi nhãn Nhiều thực phẩm bổ sung không phép bị thu hồi
Nhiều thực phẩm bổ sung không phép bị thu hồi Phạt 280 triệu đồng 3 công ty dược
Phạt 280 triệu đồng 3 công ty dược Thanh Hóa: Nhiều loại thuốc không đạt tiêu chuẩn chất lượng và chưa được phép lưu hành
Thanh Hóa: Nhiều loại thuốc không đạt tiêu chuẩn chất lượng và chưa được phép lưu hành Mỹ phẩm bị thu hồi vì chứa chất cấm, lấy mẫu kiểm nghiệm
Mỹ phẩm bị thu hồi vì chứa chất cấm, lấy mẫu kiểm nghiệm Nhiễm khuẩn Salmonella - điều cần biết về nguyên nhân thu hồi hàng triệu quả trứng ở Mỹ trong tháng qua
Nhiễm khuẩn Salmonella - điều cần biết về nguyên nhân thu hồi hàng triệu quả trứng ở Mỹ trong tháng qua Tạm đình chỉ bác sĩ phẫu thuật bướu cổ làm đứt thực quản
Tạm đình chỉ bác sĩ phẫu thuật bướu cổ làm đứt thực quản Diễn viên Phi Thanh Vân: 'Mỹ phẩm bị thu hồi là lô cũ đã ngưng sản xuất'
Diễn viên Phi Thanh Vân: 'Mỹ phẩm bị thu hồi là lô cũ đã ngưng sản xuất' Thanh Hóa: Tuyệt đối không mua, bán sản phẩm Vinaca ung thư Co3.2
Thanh Hóa: Tuyệt đối không mua, bán sản phẩm Vinaca ung thư Co3.2 Vụ thuốc ung thư làm từ bột tre nứa: Bộ Y tế khuyến khích người dân phát hiện cơ sở sản xuất thực phẩm chức năng giả
Vụ thuốc ung thư làm từ bột tre nứa: Bộ Y tế khuyến khích người dân phát hiện cơ sở sản xuất thực phẩm chức năng giả Chuyên gia hướng dẫn cách xử trí tai nạn do ong đốt
Chuyên gia hướng dẫn cách xử trí tai nạn do ong đốt Trà chanh gừng - Thức uống dân dã, công dụng bất ngờ
Trà chanh gừng - Thức uống dân dã, công dụng bất ngờ TPHCM: Bình gas mini ở quán nhậu phát nổ nửa đêm, nhiều người bỏng đen mặt
TPHCM: Bình gas mini ở quán nhậu phát nổ nửa đêm, nhiều người bỏng đen mặt 2 sai lầm khi tập luyện hại gan, thận, tim
2 sai lầm khi tập luyện hại gan, thận, tim Cô gái tử vong sau 5 ngày phát hiện đau họng, bác sĩ chỉ ra 5 dấu hiệu cần đi khám ngay
Cô gái tử vong sau 5 ngày phát hiện đau họng, bác sĩ chỉ ra 5 dấu hiệu cần đi khám ngay Cứu sống người phụ nữ có khối u 'khủng' bị xoắn, nguy cơ vỡ
Cứu sống người phụ nữ có khối u 'khủng' bị xoắn, nguy cơ vỡ Chuyên gia kỳ vọng vaccine ung thư của Nga: Xóa "án tử", thêm cơ hội sống
Chuyên gia kỳ vọng vaccine ung thư của Nga: Xóa "án tử", thêm cơ hội sống 7 lầm tưởng phổ biến về đau cơ sau tập luyện và cách ngăn ngừa
7 lầm tưởng phổ biến về đau cơ sau tập luyện và cách ngăn ngừa Chồng "biến mất" ngay trong đêm tân hôn, vợ rụng rời khi biết lý do
Chồng "biến mất" ngay trong đêm tân hôn, vợ rụng rời khi biết lý do VĐV bóng chuyền Đặng Thị Hồng bị cấm thi đấu vô thời hạn
VĐV bóng chuyền Đặng Thị Hồng bị cấm thi đấu vô thời hạn 3 cặp "phim giả tình thật" hot nhất showbiz đã tan: Độ phũ của 2 mỹ nhân này cộng lại cũng chào thua độ lụy của "em gái quốc dân"!
3 cặp "phim giả tình thật" hot nhất showbiz đã tan: Độ phũ của 2 mỹ nhân này cộng lại cũng chào thua độ lụy của "em gái quốc dân"! Bà mất, chị dâu vội vàng xin chiếc áo khoác cũ và bí mật đáng sợ phía sau
Bà mất, chị dâu vội vàng xin chiếc áo khoác cũ và bí mật đáng sợ phía sau Diễn viên Vu Mông Lung 37 tuổi qua đời đột ngột vì ngã lầu
Diễn viên Vu Mông Lung 37 tuổi qua đời đột ngột vì ngã lầu Đúng ngày mai, thứ Sáu 12/9/2025, 3 con giáp cầu được ước thấy, sớm thành Đại Gia, tiền của ngập kho, may mắn chạm ĐỈNH, mọi điều hanh thông
Đúng ngày mai, thứ Sáu 12/9/2025, 3 con giáp cầu được ước thấy, sớm thành Đại Gia, tiền của ngập kho, may mắn chạm ĐỈNH, mọi điều hanh thông Công an điều tra các hành vi khác của chủ nha khoa Tuyết Chinh ở TPHCM
Công an điều tra các hành vi khác của chủ nha khoa Tuyết Chinh ở TPHCM Tăng Thanh Hà trùm kín mặt, lặng lẽ đứng 1 góc trong tang lễ của bố diễn viên Quốc Cường
Tăng Thanh Hà trùm kín mặt, lặng lẽ đứng 1 góc trong tang lễ của bố diễn viên Quốc Cường Chấn động Cbiz: Rộ tin 1 mỹ nam cổ trang hàng đầu vừa tử vong vì ngã lầu
Chấn động Cbiz: Rộ tin 1 mỹ nam cổ trang hàng đầu vừa tử vong vì ngã lầu Mỹ: Chấn động vụ nữ nghệ sĩ trẻ Ukraine bị sát hại trên tàu điện
Mỹ: Chấn động vụ nữ nghệ sĩ trẻ Ukraine bị sát hại trên tàu điện Lời khai của bà chủ phòng khám nha khoa Tuyết Chinh hành hung khách hàng
Lời khai của bà chủ phòng khám nha khoa Tuyết Chinh hành hung khách hàng Vén màn hệ sinh thái "đẻ ra trứng vàng" của "nữ đại gia quận 7": Sự thật chồng là Tổng giám đốc VB Group, vợ sản xuất phim doanh thu hàng trăm tỷ đồng?
Vén màn hệ sinh thái "đẻ ra trứng vàng" của "nữ đại gia quận 7": Sự thật chồng là Tổng giám đốc VB Group, vợ sản xuất phim doanh thu hàng trăm tỷ đồng? Vợ cựu thủ tướng Nepal tử vong do nhà riêng bị phóng hỏa giữa biểu tình
Vợ cựu thủ tướng Nepal tử vong do nhà riêng bị phóng hỏa giữa biểu tình Chấn động vụ "ngọc nữ" bị ông lớn giở đồi bại: Mắc bệnh tâm thần và ra đi trong cô độc ở tuổi 55
Chấn động vụ "ngọc nữ" bị ông lớn giở đồi bại: Mắc bệnh tâm thần và ra đi trong cô độc ở tuổi 55 Cô gái lén lút làm điều này ở tiệm nail, rồi ngang nhiên đặt hàng trên Shopee
Cô gái lén lút làm điều này ở tiệm nail, rồi ngang nhiên đặt hàng trên Shopee Mỹ nhân nổi tiếng nhất Mưa Đỏ: Nhan sắc mướt mắt mê hoặc 6 triệu fan, không biết khen sao cho đủ
Mỹ nhân nổi tiếng nhất Mưa Đỏ: Nhan sắc mướt mắt mê hoặc 6 triệu fan, không biết khen sao cho đủ Bố qua đời sau một ngày nói hiến tạng cho mẹ, bé gái 11 tuổi nghẹn ngào
Bố qua đời sau một ngày nói hiến tạng cho mẹ, bé gái 11 tuổi nghẹn ngào Diễn viên Thiên An bất ngờ tung full tin nhắn làm giấy khai sinh, lần đầu đáp trả về họp báo 2 tiếng
Diễn viên Thiên An bất ngờ tung full tin nhắn làm giấy khai sinh, lần đầu đáp trả về họp báo 2 tiếng