Mỹ phê chuẩn thuốc điều trị ung thư phổi tế bào nhỏ
Ngày 16/5, Cơ quan Quản lý thực phẩm và dược phẩm (FDA) của Mỹ đã phê duyệt nhanh thuốc Tarlatamab của công ty dược phẩm Amgen, một liệu pháp miễn dịch điều trị cho những người trưởng thành mắc ung thư phổi tế bào nhỏ ở giai đoạn cuối dù bệnh nhân đã thực hiện hóa trị trước đó.
Tarlatamab, được bán trên thị trường với tên thương mại Imdelltra , là liệu pháp miễn dịch nhắm mục tiêu sử dụng kháng thể đặc hiệu để gắn vào tế bào ung thư và tế bào miễn dịch , từ đó kích hoạt hệ thống miễn dịch của cơ thể tấn công và tiêu diệt ung thư.
Kết quả thử nghiệm lâm sàng giai đoạn giữa được công bố năm ngoái trên Tạp chí Y học New England cho thấy Imdelltra giúp thu nhỏ đáng kể khối u ở 40% bệnh nhân được điều trị với liều lượng 10mg tarlatamab được truyền qua đường tĩnh mạch 2 tuần/lần.
Tuy nhiên, FDA yêu cầu Amgen phải hoàn thành thêm một thử nghiệm lâm sàng quy mô lớn hơn để xác nhận hiệu quả và độ an toàn của Imdelltra trước khi được phê duyệt đầy đủ.
Hiện tại, Imdelltra có giá 31.500 USD cho liệu trình đầu và 30.000 USD cho các liệu trình tiếp theo. Chi phí điều trị cho một năm có thể lên tới 781.500 USD.
Tác dụng phụ phổ biến nhất của Imdelltra là hội chứng giải phóng cytokine, có thể gây ra các phản ứng miễn dịch nghiêm trọng.
Với tiềm năng cải thiện đáng kể tỷ lệ sống sót cho bệnh nhân mắc ung thư phổi tế bào nhỏ giai đoạn cuối, Imdelltra được đánh giá cao như một phương pháp điều trị đầy hứa hẹn. Amgen cũng đang nghiên cứu ứng dụng Imdelltra cho bệnh nhân mắc ung thư phổi tế bào nhỏ giai đoạn đầu. Các nhà phân tích dự đoán Imdelltra có thể mang lại doanh thu hơn 2 tỷ USD mỗi năm cho Amgen nếu nghiên cứu trên thành công.
Ung thư phổi là một căn bệnh ung thư ác tính, xảy ra khi các tế bào gây ung thư phát triển mạnh mẽ trong các mô phổi. Các tế bào này tăng sinh nhanh chóng và khó có thể kiểm soát được, dần dần hình thành nên các khối u ác tính và có khả năng xâm lấn vào các bộ phận khác rất cao nếu không được điều trị kịp thời. Đa số bệnh nhân được phát hiện ung thư phổi tế bào nhỏ khi bệnh đã ở giai đoạn tiến triển, khiến việc điều trị càng thêm phức tạp và tỷ lệ thành công thấp.
Xin cấp phép thuốc Leclaza làm liệu pháp đầu tiên điều trị ung thư phổi
Ngày 6/12, công ty dược phẩm Hàn Quốc Yuhan cho biết vào năm tới, công ty sẽ đề nghị Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) của Mỹ cấp phép cho thuốc Leclaza do công ty này bào chế là liệu pháp điều trị đầu tiên cho bệnh nhân ung thư phổi.
Thuốc Leclaza (lazertinib) là một loại thuốc điều trị ung thư phổi không tế bào nhỏ (NSCLC) thế hệ thứ 3. Ảnh: Yuhan
Thuốc Leclaza (lazertinib) là một loại thuốc điều trị ung thư phổi không tế bào nhỏ (NSCLC) thế hệ thứ 3. Công ty Yuhan nêu rõ trong các cuộc thử nghiệm lâm sàng giai đoạn 3 tại nhiều quốc gia, thuốc Leclaza ghi nhận thời gian sống thêm không tiến triển (PFS) là 20,6 tháng, tức là bệnh nhân không có triệu chứng bệnh trầm trọng hơn trong giai đoạn này. Thời gian trên lâu hơn so với PFS 9,7 tháng khi dùng thuốc điều trị NSCLC Iressa (gefitinib) do hãng AstraZeneca bào chế. Năm 2015, thuốc Iressa đã được FDA cấp phép là liệu pháp điều trị đầu tiên cho bệnh nhân NSCLC.
Phát biểu tại một cuộc họp báo ở Seoul, Giám đốc điều hành của Yuhan, Cho Wook-je cho biết kết quả các cuộc thử nghiệm lâm sàng giai đoạn 3 đối với Leclaza trên toàn cầu được đánh giá tích cực và cho thấy tiềm năng trở thành liệu pháp điều trị đầu tiên. Dự kiến vào năm 2023, công ty phối hợp với Janssen sẽ nộp đơn xin FDA Mỹ cấp phép để thuốc Leclaza trở thành liệu pháp điều trị đầu tiên cho bệnh nhân NSCLC.
Năm ngoái, thuốc Leclaza đã được Cơ quan Quản lý Dược phẩm Hàn Quốc phê duyệt là liệu pháp điều trị thứ hai cho bệnh nhân khi phương pháp điều trị đầu tiên không hiệu quả. Hãng dược phẩm Janssen nắm quyền kinh doanh Leclaza trên toàn cầu.
Mỹ thử nghiệm phác đồ điều trị hội chứng COVID-19 kéo dài  Ngày 8/5, Viện Y tế quốc gia Mỹ (NIH) cho biết sẽ bắt đầu tiến hành các thử nghiệm lâm sàng để kiểm tra hiệu quả của các phác đồ điều trị tiềm năng đối với các hội chứng COVID-19 kéo dài, trong đó có rối loạn giấc ngủ, giảm khả năng tập thể dục và mệt mỏi do gắng sức (PEM). Người...
Ngày 8/5, Viện Y tế quốc gia Mỹ (NIH) cho biết sẽ bắt đầu tiến hành các thử nghiệm lâm sàng để kiểm tra hiệu quả của các phác đồ điều trị tiềm năng đối với các hội chứng COVID-19 kéo dài, trong đó có rối loạn giấc ngủ, giảm khả năng tập thể dục và mệt mỏi do gắng sức (PEM). Người...
 Người gốc Việt nổ súng ngăn vụ cướp tiệm vàng ở California01:48
Người gốc Việt nổ súng ngăn vụ cướp tiệm vàng ở California01:48 Chân dung nghi phạm 22 tuổi ám sát đồng minh của Tổng thống Mỹ Donald Trump03:08
Chân dung nghi phạm 22 tuổi ám sát đồng minh của Tổng thống Mỹ Donald Trump03:08 Phó Tổng thống Mỹ khiêng quan tài của nhà hoạt động bị ám sát01:40
Phó Tổng thống Mỹ khiêng quan tài của nhà hoạt động bị ám sát01:40 Bí ẩn "vật thể lạ" trên Google Maps, nghi UFO ở Nam Cực, khiến thế giới sửng sốt02:33
Bí ẩn "vật thể lạ" trên Google Maps, nghi UFO ở Nam Cực, khiến thế giới sửng sốt02:33 Máy bay SpiceJet rơi bánh khi cất cánh, 70 hành khách thoát nạn04:36
Máy bay SpiceJet rơi bánh khi cất cánh, 70 hành khách thoát nạn04:36 Bạo lực chính trị giữa nước Mỹ bị chia rẽ07:55
Bạo lực chính trị giữa nước Mỹ bị chia rẽ07:55 Romania xuất kích máy bay chiến đấu, Ba Lan đóng cửa sân bay vì cảnh báo UAV09:08
Romania xuất kích máy bay chiến đấu, Ba Lan đóng cửa sân bay vì cảnh báo UAV09:08 Venezuela tố Mỹ 'bắt giữ trái phép' tàu cá giữa lúc căng thẳng06:57
Venezuela tố Mỹ 'bắt giữ trái phép' tàu cá giữa lúc căng thẳng06:57 Tân Thủ tướng Nepal tuyên bố sẽ không cầm quyền quá 6 tháng07:50
Tân Thủ tướng Nepal tuyên bố sẽ không cầm quyền quá 6 tháng07:50 Dải Gaza giữa những ngổn ngang08:07
Dải Gaza giữa những ngổn ngang08:07 SpaceX phóng tàu chở hàng 4,99 tấn lên Trạm Vũ trụ Quốc tế21:34
SpaceX phóng tàu chở hàng 4,99 tấn lên Trạm Vũ trụ Quốc tế21:34Tiêu điểm
Tin đang nóng
Tin mới nhất

Cựu Tổng thống Pháp Nicolas Sarkozy bị tuyên án 5 năm tù

Khắc tinh khiến "hung thần đại dương" chỉ còn xác không nội tạng

Mỹ điều tra túi khí kém chất lượng từ Trung Quốc gây chết người

Ukraine dồn dập tập kích cơ sở dầu lớn trong lãnh thổ Nga

Người đàn ông bị phạt tiền vì giấu chuyện có vợ, làm khổ một cô gái

Iran tuyên bố xâm nhập cơ sở hạt nhân tuyệt mật của Israel

Sơ tán cư dân sau vụ nổ lớn gây hỏa hoạn tại khu công nghiệp của Anh

Thủ tướng Thái Lan nêu 4 ưu tiên trong dự thảo chính sách

Hàn Quốc khuyến khích người cha nghỉ phép chăm con

Nhật Bản và Mỹ sắp xếp chuyến thăm của Tổng thống Donald Trump

Iran khẳng định không theo đuổi vũ khí hạt nhân

Không quân Ukraine tuyên bố bắn hạ chiến đấu cơ Su-34 của Liên bang Nga trên hướng Zaporizhzhia
Có thể bạn quan tâm

Ngắm mỹ nhân này mới biết thần tiên cổ tích là có thật: Nhan sắc như hoa như ngọc, Việt Nam mấy ai sánh bằng
Hậu trường phim
23:30:20 25/09/2025
Tranh luận Nhã Phương mang bầu lần ba
Sao việt
23:20:22 25/09/2025
Selena Gomez lộ tin nóng về "đám cưới thế kỷ", "gái hư Hollywood" là khách mời đầu tiên?
Sao âu mỹ
23:17:44 25/09/2025
Tập 8 Sao Nhập Ngũ 2025: Duy Khánh - Diệu Nhi "tấu hài" đỡ không nổi, Chi Pu khiến cả dàn cast kinh ngạc!
Tv show
23:15:28 25/09/2025
'Star Wars' trở lại với bom tấn 'The Mandalorian and Grogu', hé lộ cuộc chiến vũ trụ mới đầy hấp dẫn
Phim âu mỹ
22:53:08 25/09/2025
Cựu danh thủ Wayne Rooney tiết lộ lý do bị HLV Ferguson loại khỏi MU
Sao thể thao
22:26:41 25/09/2025
Nữ du khách trèo lên lan can, đứng chênh vênh chụp ảnh ở Tà Xùa gây xôn xao
Netizen
22:26:03 25/09/2025
Võ Hạ Trâm tiết lộ mối quan hệ đặc biệt với Vy Oanh
Nhạc việt
22:22:45 25/09/2025
Thủ đoạn tinh vi chiếm đoạt 18 tỷ đồng của "liên minh đa cấp"
Pháp luật
22:10:34 25/09/2025
Quan điểm "phụ nữ không phải sinh con" gây tranh cãi của chị đẹp Trung Quốc
Sao châu á
22:03:10 25/09/2025
 Báo động về tình trạng san hô tẩy trắng lan rộng toàn cầu
Báo động về tình trạng san hô tẩy trắng lan rộng toàn cầu Brazil sử dụng máy bơm lớn để hút nước ở các khu vực lũ lụt
Brazil sử dụng máy bơm lớn để hút nước ở các khu vực lũ lụt
 Thuốc tiểu đường của Cuba được cấp phép thử nghiệm lâm sàng ở Mỹ
Thuốc tiểu đường của Cuba được cấp phép thử nghiệm lâm sàng ở Mỹ Mỹ lần đầu cấp phép thuốc điều trị gan nhiễm mỡ không do rượu dạng nặng
Mỹ lần đầu cấp phép thuốc điều trị gan nhiễm mỡ không do rượu dạng nặng WHO dự đoán số ca mắc ung thư toàn cầu đến năm 2050 sẽ tăng hơn 75%
WHO dự đoán số ca mắc ung thư toàn cầu đến năm 2050 sẽ tăng hơn 75% Biến đổi khí hậu khiến hàng triệu người Bangladesh rủi ro mắc ung thư
Biến đổi khí hậu khiến hàng triệu người Bangladesh rủi ro mắc ung thư Australia là quốc gia đầu tiên cấm đá nhân tạo
Australia là quốc gia đầu tiên cấm đá nhân tạo Mỹ: Bắt đầu thử nghiệm lâm sàng vaccine ngừa HIV
Mỹ: Bắt đầu thử nghiệm lâm sàng vaccine ngừa HIV COVID-19: Vaccine cải tiến của Moderna, Pfizer có hiệu quả cao trong ngừa biến thể BA.2.86
COVID-19: Vaccine cải tiến của Moderna, Pfizer có hiệu quả cao trong ngừa biến thể BA.2.86 Phát triển loại thuốc giúp răng mọc lại nhiều lần
Phát triển loại thuốc giúp răng mọc lại nhiều lần Công ty của Elon Musk được phép thử nghiệm cấy chip vào não người
Công ty của Elon Musk được phép thử nghiệm cấy chip vào não người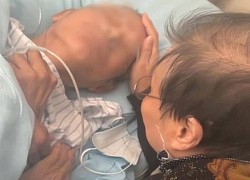 Cụ ông gần đất xa trời, cụ bà nói một câu ai cũng chảy nước mắt
Cụ ông gần đất xa trời, cụ bà nói một câu ai cũng chảy nước mắt Cảnh tan hoang sau khi bão Ragasa quét qua Trung Quốc
Cảnh tan hoang sau khi bão Ragasa quét qua Trung Quốc Tổng thống Mỹ ra điều kiện với Nga về kịch bản "trừng phạt mạnh mẽ"
Tổng thống Mỹ ra điều kiện với Nga về kịch bản "trừng phạt mạnh mẽ" Tổng thống Donald Trump gặp sự cố thang cuốn ở Liên hợp quốc
Tổng thống Donald Trump gặp sự cố thang cuốn ở Liên hợp quốc Mỹ phát thông điệp cứng rắn về xung đột Nga - Ukraine
Mỹ phát thông điệp cứng rắn về xung đột Nga - Ukraine
 Xe goòng rơi xuống sườn núi, 7 nhà sư tử nạn
Xe goòng rơi xuống sườn núi, 7 nhà sư tử nạn Ukraine tuyên bố không trao đổi lãnh thổ với Nga
Ukraine tuyên bố không trao đổi lãnh thổ với Nga Thủ tướng Thái Lan thông báo thời điểm sẽ giải tán quốc hội
Thủ tướng Thái Lan thông báo thời điểm sẽ giải tán quốc hội Nhanh như gió: Nữ diễn viên hạng A cưới chạy bầu ly hôn chồng sau 1 năm cưới?
Nhanh như gió: Nữ diễn viên hạng A cưới chạy bầu ly hôn chồng sau 1 năm cưới? Không có chỗ đỗ nên để tạm ô tô ở ven đường, người phụ nữ chết lặng khi chứng kiến cảnh bên trong xe
Không có chỗ đỗ nên để tạm ô tô ở ven đường, người phụ nữ chết lặng khi chứng kiến cảnh bên trong xe Làm ơn đừng đưa nước tẩy trang cho 5 mỹ nhân showbiz này kẻo lại thất vọng!
Làm ơn đừng đưa nước tẩy trang cho 5 mỹ nhân showbiz này kẻo lại thất vọng! Tranh cãi chuyện hoa hậu chuyển giới Hương Giang đi thi "Miss Universe 2025"
Tranh cãi chuyện hoa hậu chuyển giới Hương Giang đi thi "Miss Universe 2025" 25 ngày từ yêu đến cưới của cô nàng 21 tuổi và anh hàng xóm
25 ngày từ yêu đến cưới của cô nàng 21 tuổi và anh hàng xóm Mỹ nhân Vbiz U65 vẫn không ai qua nổi: Được phong "Hoa hậu không ngai", suốt 40 năm không ăn cơm
Mỹ nhân Vbiz U65 vẫn không ai qua nổi: Được phong "Hoa hậu không ngai", suốt 40 năm không ăn cơm 2 ngôi sao bị ghét nhất Cbiz, đến mức nhập viện còn khiến netizen hả hê
2 ngôi sao bị ghét nhất Cbiz, đến mức nhập viện còn khiến netizen hả hê Khách đóng giả 'tổng tài' ra lệnh đánh người, quán nhận 'bão' 1 sao
Khách đóng giả 'tổng tài' ra lệnh đánh người, quán nhận 'bão' 1 sao Lá thư xúc động bố ca sĩ Đức Phúc gửi Mỹ Tâm và Hồ Hoài Anh
Lá thư xúc động bố ca sĩ Đức Phúc gửi Mỹ Tâm và Hồ Hoài Anh Sự thật về vụ tự tử của người phụ nữ bán rau bị cướp điện thoại
Sự thật về vụ tự tử của người phụ nữ bán rau bị cướp điện thoại Phương Oanh tổ chức sinh nhật ấm áp tình thân cho Shark Bình, thái độ của 2 con riêng nói lên tất cả
Phương Oanh tổ chức sinh nhật ấm áp tình thân cho Shark Bình, thái độ của 2 con riêng nói lên tất cả Lời khai của nghi phạm vụ người phụ nữ tử vong sau khi bị cướp điện thoại
Lời khai của nghi phạm vụ người phụ nữ tử vong sau khi bị cướp điện thoại Không cản nổi sức công phá của Đức Phúc: Phù Đổng Thiên Vương lọt Top Trending thế giới, viral loạt quốc gia quá đỉnh!
Không cản nổi sức công phá của Đức Phúc: Phù Đổng Thiên Vương lọt Top Trending thế giới, viral loạt quốc gia quá đỉnh! 5 mỹ nhân có gương mặt đẹp nhất Trung Quốc: Địch Lệ Nhiệt Ba lại thua Dương Mịch, hạng 1 không ai dám cãi
5 mỹ nhân có gương mặt đẹp nhất Trung Quốc: Địch Lệ Nhiệt Ba lại thua Dương Mịch, hạng 1 không ai dám cãi Sốc: Hương Giang là đại diện Việt Nam thi Miss Universe 2025!
Sốc: Hương Giang là đại diện Việt Nam thi Miss Universe 2025! Diện váy 5 triệu đồng ra mắt mẹ bạn trai, tôi cay đắng khi nhận ra bà là ai
Diện váy 5 triệu đồng ra mắt mẹ bạn trai, tôi cay đắng khi nhận ra bà là ai Mỹ nhân showbiz 50 tuổi, body nóng bỏng bị chồng "phi công" đòi ly dị vì không thể sinh con
Mỹ nhân showbiz 50 tuổi, body nóng bỏng bị chồng "phi công" đòi ly dị vì không thể sinh con Phú Thọ: Tạm giam đối tượng hành hung người phụ nữ
Phú Thọ: Tạm giam đối tượng hành hung người phụ nữ