Mỹ ngừng cấp phép sử dụng thuốc Evusheld do thiếu hiệu quả với dòng phụ XBB.1.5
Ngày 26/1, Cục Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) đã ra thông báo dừng cấp phép sử dụng khẩn cấp đối với thuốc dự phòng COVID-19 bằng kháng thể đơn dòng Evusheld do không hiệu quả với các biến thể của virus SARS-CoV-2 hiện đang lây lan mạnh ở Mỹ.

Thuốc Evusheld của hãng dược AstraZeneca, tại Stockholm, Thụy Điển, ngày 8/2/2022. Ảnh: AFP/TTXVN
Theo phóng viên TTXVN tại Mỹ, thông báo trên được FDA đưa ra vài tuần sau khi cơ quan này cho biết Evusheld không có hiệu quả đối với dòng phụ XBB.1.5 của biến thể Omicron, biến thể đang gây lây nhiễm cho 61% số ca bệnh ở Mỹ.
FDA cho biết trong bối cảnh Evusheld chỉ có tác dụng đối với chưa đến 10% các dòng phụ gây lây nhiễm tại Mỹ, việc ngừng cấp phép sử dụng loại thuốc này sẽ giúp giảm thiểu tình trạng bệnh nhân có thể bị các tác dụng phụ do sử dụng thuốc, như phản ứng dị ứng.
Theo thông cáo báo chí của nhà sản xuất Evusheld AstraZeneca, dữ liệu từ phòng thí nghiệm cho thấy loại thuốc này không hiệu quả đối với nhiều dòng phụ của biến thể Omicron, trong đó có 3 dòng phụ đang lây nhiễm chủ yếu ở Mỹ là XBB.1.5, BQ.1.1 và BQ.1.
Sự biến đổi liên tục của virus SARS-CoV-2 đang khiến các phương pháp điều trị tương tự khác trở nên lỗi thời. Vào tháng 11 vừa qua, FDA đã tạm dừng cấp phép cho liệu pháp kháng thể đơn dòng Bebtelovimab. FDA khuyến cáo bệnh nhân có các triệu chứng của COVID-19 nên tìm kiếm những phương pháp điều trị như Paxlovid, Remdesivir hoặc Molnupiravir, các thuốc kháng virus được cho là vẫn có hiệu quả trong điều trị COVID-19.
Tuy nhiên, FDA cũng khuyến cáo các cửa hàng dược phẩm nên giữ lại thuốc Evusheld còn tồn kho, phòng trường hợp các biến thể mà thuốc này có tác dụng trở nên phổ biến trong tương lai.
Mỹ: Vaccine COVID-19 cải tiến có thể ngừa các dòng phụ mới của biến thể Omicron
Trung tâm Kiểm soát và Phòng ngừa dịch bệnh (CDC) của Mỹ ngày 25/1 cho biết các loại vaccine COVID-19 thể lưỡng trị được cải tiến của Pfizer Inc/BioNTech và Moderna đã giúp ngăn ngừa nguy cơ mắc bệnh có triệu chứng đối với các dòng phụ XBB của biến thể Omicron.

Vaccine ngừa COVID-19 của hãng dược phẩm Pfizer-BioNTech. Ảnh minh họa: AFP/TTXVN
Phân tích của CDC Mỹ cho thấy loại vaccine được nâng cấp nhằm phòng chống các dòng phụ BA.4 và BA.5 của biến thể Omicron và chủng virus gốc đã giúp ngăn ngừa khả năng mắc bệnh ở những người tiêm từ 2 đến 4 liều vaccine ngừa COVID-19 trước đó.
Theo kết quả phân tích được thực hiện từ ngày 1/12/2022 đến ngày 13/1/2023, khoảng thời gian các dòng phụ XBB và XBB.1.5 của biến thể Omicron lây lan mạnh ở Mỹ, loại vaccine được cải tiến có hiệu quả phòng ngừa đối với cả các dòng phụ BA.5 và XBB/XBB.1.5. Theo đó, loại vaccine này đã giúp giảm 52% nguy cơ nhiễm BA.5 và 48% nguy cơ nhiễm XBB/XBB.1.5 ở những người từ 18-49 tuổi, trong khi giúp giảm 37% nguy cơ nhiễm BA.5 và 43% nguy cơ nhiễm XBB/XBB.1.5 đối với nhóm người từ 65 tuổi trở lên.
Theo CDC Mỹ, nghiên cứu này cho thấy hiệu quả của vaccine, nhưng người dân có thể không nhận ra lợi ích của tiêm chủng. Do đó, CDC Mỹ khuyến nghị người dân tiếp tục tiêm các loại vaccine ngừa COVID-19 được khuyến cáo. Theo số liệu của chính phủ, số ca nhiễm dòng phụ XBB.1.5 chiếm gần 50% số ca COVID-19 tại Mỹ trong tuần tính đến ngày 21/1 vừa qua.
Trong khi đó, Cơ quan Quản lý thực phẩm và dược phẩm Mỹ (FDA) vừa đề xuất kế hoạch tiêm phòng COVID-19 một liều duy nhất cho người dân vào mùa Thu hằng năm, giống như tiêm phòng cúm. Theo FDA, trong tương lai, hầu hết mọi người dân có thể chỉ cần một liều vaccine ngừa COVID-19 mới nhất để khôi phục khả năng đề kháng, bất kể họ đã tiêm bao nhiêu liều trước đó. Tuy nhiên, đề nghị này đã khiến một số nhà khoa học ngạc nhiên, trong đó có một số cố vấn riêng của FDA và họ dự kiến nhóm họp vào ngày 26/1 để thảo luận về chiến lược tiêm phòng COVID-19 mới, bao gồm cả liều lượng và lịch trình tiêm chủng.
Mỹ thu hồi thuốc điều trị huyết áp do nguy cơ dẫn đến ung thư  Phóng viên TTXVN tại Washington dẫn thông tin từ Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) cho biết hãng dược phẩm Lupin Pharmaceuticals đang phải thu hồi 4 lô thuốc điều trị huyết áp dạng viên nén Quinapril của hãng này do phát hiện một tạp chất được gọi là Nitrosamine trong quá trình thử nghiệm sản phẩm. FDA...
Phóng viên TTXVN tại Washington dẫn thông tin từ Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) cho biết hãng dược phẩm Lupin Pharmaceuticals đang phải thu hồi 4 lô thuốc điều trị huyết áp dạng viên nén Quinapril của hãng này do phát hiện một tạp chất được gọi là Nitrosamine trong quá trình thử nghiệm sản phẩm. FDA...
 Tang lễ Giáo hoàng Francis: Mộ phần đơn giản và thánh đường không ngủ01:37
Tang lễ Giáo hoàng Francis: Mộ phần đơn giản và thánh đường không ngủ01:37 Giáo hoàng Francis về với thánh đường Vatican lần cuối09:39
Giáo hoàng Francis về với thánh đường Vatican lần cuối09:39 Tiết lộ chiến đấu cơ tàng hình tối tân của Mỹ, uy lực số 1 thế giới17:39
Tiết lộ chiến đấu cơ tàng hình tối tân của Mỹ, uy lực số 1 thế giới17:39 Bác sĩ kể lại giờ phút cuối và điều tiếc nuối của Giáo hoàng Francis09:47
Bác sĩ kể lại giờ phút cuối và điều tiếc nuối của Giáo hoàng Francis09:47 Houthi lại bắn hạ MQ-9, Mỹ tập kích Yemen dồn dập08:25
Houthi lại bắn hạ MQ-9, Mỹ tập kích Yemen dồn dập08:25 Tổng thống Trump đến Rome dự tang lễ Giáo hoàng Francis09:43
Tổng thống Trump đến Rome dự tang lễ Giáo hoàng Francis09:43 Iran công bố nguyên nhân vụ cháy nổ thảm khốc ở cảng01:49
Iran công bố nguyên nhân vụ cháy nổ thảm khốc ở cảng01:49 Chiến hạm nước ngoài đầu tiên đến căn cứ Ream của Campuchia sau quá trình cải tạo08:38
Chiến hạm nước ngoài đầu tiên đến căn cứ Ream của Campuchia sau quá trình cải tạo08:38 NATO tăng mạnh hiện diện quân sự ở biển Baltic08:10
NATO tăng mạnh hiện diện quân sự ở biển Baltic08:10 Xả súng ở trường gà Ecuador, ít nhất 12 người chết01:50
Xả súng ở trường gà Ecuador, ít nhất 12 người chết01:50 "Truyền nhân" Vanga dự đoán thảm họa lớn xảy ra vào tháng 7, dư luận hoang mang05:05
"Truyền nhân" Vanga dự đoán thảm họa lớn xảy ra vào tháng 7, dư luận hoang mang05:05Tiêu điểm
Tin đang nóng
Tin mới nhất

Rộ tin Mỹ cắt giảm hơn 1.000 nhân viên tình báo CIA

Mỹ sẽ tổ chức diễu binh vào sinh nhật ông Trump, thị trưởng Washington lo ngại

Quân đội Mỹ lập khu quân sự mới sát Mexico

Xung quanh việc Mỹ đưa ra quyết định then chốt tăng cường sức mạnh không quân Ukraine - Kỳ cuối

Bầu cử Australia: Thủ tướng Anthony Albanese phát biểu mừng chiến thắng

Tại sao Trung Quốc có thể thắng trong cuộc chiến thương mại với Mỹ thời Trump?

Xung quanh việc Mỹ đưa ra quyết định then chốt tăng cường sức mạnh không quân Ukraine - Kỳ 1

Phó Tổng thống Mỹ nhận định về thời điểm kết thúc xung đột giữa Nga và Ukraine

Hàng loạt chính sách nhập cư của Tổng thống Trump bị tòa án Mỹ bác bỏ

Iran tái khẳng định quyền sở hữu chu trình nhiên liệu hạt nhân đầy đủ

OPEC+ nhất trí tăng sản lượng dầu trong tháng 6

Thủ tướng Yemen từ chức
Có thể bạn quan tâm

Cô gái nghèo lột xác đỉnh nhất Hàn Quốc: Từ Song Hye Kyo "bản dupe" đến nữ hoàng màn ảnh triệu người say mê
Hậu trường phim
23:44:37 04/05/2025
Mỹ nhân cả nước biết mặt: Từng chảnh chọe, chèn ép người khác, cuộc sống tuổi 53 ra sao sau khi giải nghệ?
Sao việt
23:39:11 04/05/2025
Hát 'Thua một người dưng', cô gái 23 tuổi được Ngọc Sơn nhắn nhủ một điều
Tv show
23:05:05 04/05/2025
Vì sao phòng ngủ của vua "khiêm tốn" thua 72.000 lần diện tích Tử cấm thành?
Netizen
23:04:34 04/05/2025
Alexander-Arnold rời Liverpool với giá rẻ bèo
Sao thể thao
23:02:43 04/05/2025
'Ngọc nữ' Nhật bản Ryoko Hirosue điều trị tâm thần sau vụ bị bắt giữ
Sao châu á
23:02:13 04/05/2025
3 giọng hát Đà Lạt 'như rót mật ngọt', một người 18 năm mới trở lại
Nhạc việt
22:36:44 04/05/2025
Bắt 34 đối tượng đá gà, lắc tài xỉu dịp nghỉ lễ, thu giữ gần 200 triệu đồng
Pháp luật
22:24:01 04/05/2025
"Nữ hoàng gợi cảm" comeback "tàng hình" không ai thèm ngó đến, bị fan tẩy chay vì mải mê yêu đương
Nhạc quốc tế
21:44:03 04/05/2025
Leonardo DiCaprio "phá bỏ lời nguyền tuổi 25", khi bạn gái người mẫu đã qua tuổi 26 nhưng vẫn không chia tay
Sao âu mỹ
21:21:28 04/05/2025
 Anh cử hai quan chức hàng đầu tham gia đàm phán Nghị định thư Bắc Ireland
Anh cử hai quan chức hàng đầu tham gia đàm phán Nghị định thư Bắc Ireland Xung đột ở Ukraine: Kiev lập phi đội tấn công UAV đầu tiên thế giới, Nga nói bắn hạ Su-25 ở Donetsk
Xung đột ở Ukraine: Kiev lập phi đội tấn công UAV đầu tiên thế giới, Nga nói bắn hạ Su-25 ở Donetsk Mỹ phê duyệt thuốc uống đầu tiên chữa tiểu đường ở mèo
Mỹ phê duyệt thuốc uống đầu tiên chữa tiểu đường ở mèo Mỹ phê duyệt liệu pháp gene sinh học Skysona điều trị rối loạn thần kinh hiếm gặp
Mỹ phê duyệt liệu pháp gene sinh học Skysona điều trị rối loạn thần kinh hiếm gặp Thụy Sĩ: Tiêm mũi tăng cường bằng vaccine Spikevax bivalent của Moderna
Thụy Sĩ: Tiêm mũi tăng cường bằng vaccine Spikevax bivalent của Moderna EMA khuyến cáo Novavax liệt kê tác dụng phụ mới của vaccine ngừa COVID-19
EMA khuyến cáo Novavax liệt kê tác dụng phụ mới của vaccine ngừa COVID-19 EMA bổ sung tác dụng phụ của vaccine ngừa COVID-19 của Novavax
EMA bổ sung tác dụng phụ của vaccine ngừa COVID-19 của Novavax Mỹ cấp phép sử dụng vaccine ngừa COVID-19 của Novavax
Mỹ cấp phép sử dụng vaccine ngừa COVID-19 của Novavax
 Mỹ đặt 2,5 triệu liều vaccine phòng bệnh đậu mùa và đậu mùa khỉ
Mỹ đặt 2,5 triệu liều vaccine phòng bệnh đậu mùa và đậu mùa khỉ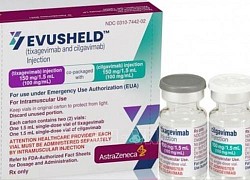 Hàn Quốc phê duyệt sử dụng kháng thể đơn dòng Evusheld phòng COVID-19 cho người miễn dịch kém
Hàn Quốc phê duyệt sử dụng kháng thể đơn dòng Evusheld phòng COVID-19 cho người miễn dịch kém Mỹ xem xét điều chỉnh thành phần vắc xin, Trung Quốc nới lỏng giãn cách Covid-19
Mỹ xem xét điều chỉnh thành phần vắc xin, Trung Quốc nới lỏng giãn cách Covid-19
 FDA điều tra vụ trẻ sơ sinh thứ 10 tử vong 'sau khi uống sữa công thức Abbott'
FDA điều tra vụ trẻ sơ sinh thứ 10 tử vong 'sau khi uống sữa công thức Abbott' Ông Medvedev: Không ai có thể đảm bảo Kiev an toàn nếu Ukraine tấn công Matxcơva ngày 9-5
Ông Medvedev: Không ai có thể đảm bảo Kiev an toàn nếu Ukraine tấn công Matxcơva ngày 9-5 Hé lộ cách cung nữ thỏa nhu cầu "sinh lý", nhiều điều khó tin nhưng có thật
Hé lộ cách cung nữ thỏa nhu cầu "sinh lý", nhiều điều khó tin nhưng có thật Bị bỏ quên trên xe đưa đón học sinh, bé trai 5 tuổi tử vong thương tâm ở Malaysia: Chia sẻ đẫm nước mắt của người bố
Bị bỏ quên trên xe đưa đón học sinh, bé trai 5 tuổi tử vong thương tâm ở Malaysia: Chia sẻ đẫm nước mắt của người bố Nga nêu quan điểm về việc Mỹ và EU cảnh báo rút khỏi đàm phán
Nga nêu quan điểm về việc Mỹ và EU cảnh báo rút khỏi đàm phán Ông Trump đăng ảnh "chế" mặc trang phục giống giáo hoàng
Ông Trump đăng ảnh "chế" mặc trang phục giống giáo hoàng Quan chức Nga cảnh báo Ukraine không khiêu khích vào Ngày Chiến thắng 9/5
Quan chức Nga cảnh báo Ukraine không khiêu khích vào Ngày Chiến thắng 9/5 Hé lộ khả năng diễu binh ở Mỹ vào sinh nhật ông Trump
Hé lộ khả năng diễu binh ở Mỹ vào sinh nhật ông Trump Thỏa thuận đất hiếm Mỹ - Ukraine khó sinh ra lợi nhuận trong 10 năm tới?
Thỏa thuận đất hiếm Mỹ - Ukraine khó sinh ra lợi nhuận trong 10 năm tới?

 "Cha đẻ" bản hit 3 tỷ lượt xem dở khóc dở cười vì bị nhầm là... cố nhạc sĩ
"Cha đẻ" bản hit 3 tỷ lượt xem dở khóc dở cười vì bị nhầm là... cố nhạc sĩ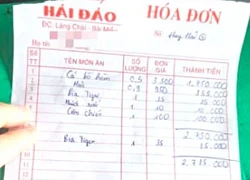 Quán ở Nha Trang bị tố "chặt chém", bán cá bò hòm 3,5 triệu đồng/kg: Chủ quán nói phải trích 30% "hoa hồng"
Quán ở Nha Trang bị tố "chặt chém", bán cá bò hòm 3,5 triệu đồng/kg: Chủ quán nói phải trích 30% "hoa hồng"
 Tạ Đình Phong chuyển nhượng khối tài sản hàng nghìn tỷ đồng cho con
Tạ Đình Phong chuyển nhượng khối tài sản hàng nghìn tỷ đồng cho con Dương Tư Kỳ: Bỏ tình đầu theo đại gia, 2 lần làm mẹ đơn thân, giờ nhận không ra
Dương Tư Kỳ: Bỏ tình đầu theo đại gia, 2 lần làm mẹ đơn thân, giờ nhận không ra Hot: Gigi Hadid chính thức công khai hẹn hò tài tử hơn 20 tuổi Bradley Cooper bằng bức hình nóng bỏng ở tiệc sinh nhật tuổi 30
Hot: Gigi Hadid chính thức công khai hẹn hò tài tử hơn 20 tuổi Bradley Cooper bằng bức hình nóng bỏng ở tiệc sinh nhật tuổi 30 Cha xử kẻ hại con: Rõ nguyên nhân TNGT, huỷ quyết định cũ, vợ kể việc làm ám ảnh
Cha xử kẻ hại con: Rõ nguyên nhân TNGT, huỷ quyết định cũ, vợ kể việc làm ám ảnh Bản hit 3 tỷ lượt xem, nhạc sĩ Nguyễn Văn Chung kiếm được bao nhiêu tiền?
Bản hit 3 tỷ lượt xem, nhạc sĩ Nguyễn Văn Chung kiếm được bao nhiêu tiền?
 VKSND Tối cao: Tài xế xe tải có lỗi trong cái chết của bé gái ở Vĩnh Long
VKSND Tối cao: Tài xế xe tải có lỗi trong cái chết của bé gái ở Vĩnh Long Hoa hậu Phương Lê mang thai lần 4 ở tuổi U50, là con chung đầu tiên với NSƯT Vũ Luân
Hoa hậu Phương Lê mang thai lần 4 ở tuổi U50, là con chung đầu tiên với NSƯT Vũ Luân Vụ 3 người tử vong trong khách sạn ở Nha Trang: Người nhà nạn nhân cung cấp tình tiết 'nóng'
Vụ 3 người tử vong trong khách sạn ở Nha Trang: Người nhà nạn nhân cung cấp tình tiết 'nóng'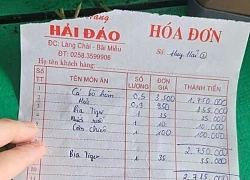 Mạng xã hội lại dậy sóng với hoá đơn thể hiện "cá bò hòm 3,5 triệu đồng/kg" ở Nha Trang
Mạng xã hội lại dậy sóng với hoá đơn thể hiện "cá bò hòm 3,5 triệu đồng/kg" ở Nha Trang

 Sát hại bảo vệ nghĩa trang ở Bình Dương rồi kể với vợ "vừa chém con cọp"
Sát hại bảo vệ nghĩa trang ở Bình Dương rồi kể với vợ "vừa chém con cọp"