Hé lộ thiết kế của Motorola Razr 2022: gọn hơn và thanh thoát hơn
Những hình ảnh mới nhất về smartphone màn hình gập Motorola Razr 2022 đã chính thức được đăng tải cùng với các thông tin về thông số kĩ thuật của thiết bị.
Motorola dự kiến sẽ giới thiệu một số mẫu smartphone Snapdragon 8 Gen 1 mới. Bên cạnh Motorola Edge 30 Ultra, những thiết bị mới cũng đang rục rịch được cho ra mắt, trong đó không thể không kể đến thiết bị màn hình có thể gập lại, Motorola Razr 2022. Mới đây, một số hình ảnh chính thức về Motorola Razr 2022 đã được chia sẻ bởi Tổng Giám đốc Lenovo Mobile Trung Quốc Chen Jin.
Hình ảnh cho thấy Motorola Razr 2022 có phần góc bo tròn hơn và phần cạnh dưới nhỏ hơn so với hai người tiền nhiệm, khá tương đồng với hầu hết các mẫu smartphone màn hình gập trên thị trường hiện nay. Trước đó, các phiên bản đầu tiên của RAZR có phần cạnh dưới khá lớn mang lại vẻ hoài cổ cho toàn bộ thiết kế.
Bên cạnh các hình ảnh, công ty cũng chia sẻ một đoạn video sản phẩm trên Weibo. Video cung cấp một số hình ảnh liên quan đến thiết kế chính như màn hình phụ bên ngoài lớn hơn, thiết lập camera kép và phần bản lề đã có sự thay đổi.
Motorola Razr 2022 có thiết kế tương tự như những chiếc smartphone màn hình gập ra mắt trong năm 2022, đặc biệt khi so sánh nó với loạt Galaxy Z Flip của Samsung. Tuy nhiên vẫn cần thêm thời gian để xem Motorola Razr 2022 có thể trở thành đối thủ nặng kí cho Galaxy Z Flip của Samsung hay không.
Theo thông tin rò rỉ, Motorola Razr 2022 sẽ có màn hình P-OLED 6,7 inch với cơ chế bản lề hoàn toàn mới và tần số quét 120 Hz. Màn hình phụ bên ngoài sẽ có kích thước 3 inch. Thiết lập camera bao gồm camera chính 50MP và camera Ultrawide 13MP. Viên pin đi kèm không quá lớn chỉ 3.000 mAh. Chiếc smartphone sẽ sử dụng con chip Qualcomm Snapdragon 8 Gen 1 với RAM lên tới 12GB và dung lượng lưu trữ ROM lên tới 512GB. Sản phẩm sẽ có mức giá khoảng 1152,69USD.
Tròn một thập kỷ CRISPR: Từ nghiên cứu bị lãng quên đến giải Nobel kiến tạo kỷ nguyên mới
Đêm sau khi bài báo của cô được đăng tải, tiến sĩ Jennifer Doudna đã gặp ác mộng. Cô mơ thấy Adolf Hitler sống lại và hỏi về cách để CRISPR những đứa trẻ.
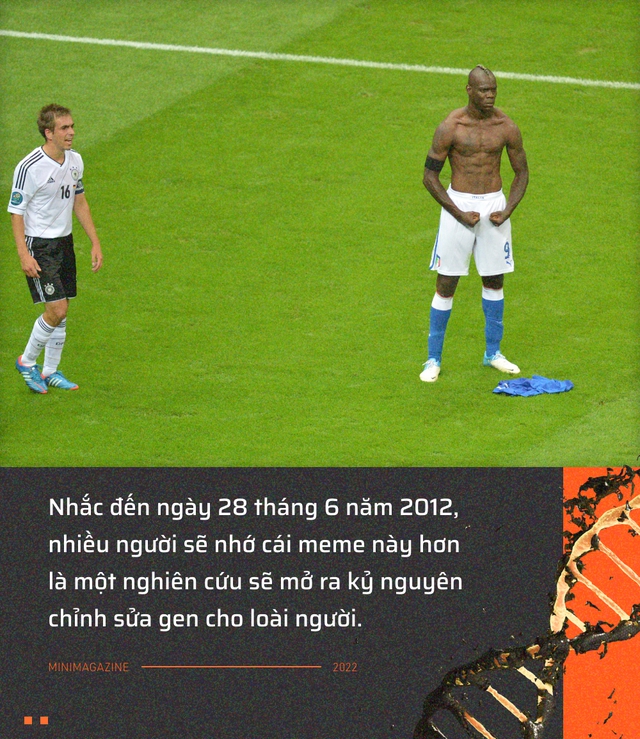
Mười năm về trước, ngày 28 tháng 6 năm 2012, thế giới vốn vẫn thật hỗn hoạn. Không thiếu những tin tức nóng hổi ngập tràn trên mặt báo:
Thổ Nhĩ Kỳ đưa các bệ phóng tên lửa của họ tới biên giới Syria. Taliban công bố video hành quyết 17 binh sĩ Pakistan bằng hình thức chặt đầu. Lũ lụt ở Anh làm tất cả các tuyến đường sắt của họ tới Scotland phải đóng cửa. Và giá cổ phiếu của ngân hàng Barclay giảm tới 17%, sau án phạt cho hành vi lũng đoạn thị trường quốc tế.
Vậy là quá đủ cho một ngày cuối tháng 6, mọi người đơn giản là không có thời gian để đọc một nghiên cứu mới đăng trên tạp chí Science: " Một enzyme cắt DNA nhắm mục tiêu bằng RNA kép có thể lập trình được trong khả năng thích ứng miễn dịch của vi khuẩn ".
Suy cho cùng, ai cần quan tâm người ta đang làm gì với một con vi khuẩn, khi đêm hôm đó Italia còn thắng Đức 2-1 trong trận bán kết EUFA Euro?
"Đây có lẽ là đêm tuyệt vời nhất trong sự nghiệp của tôi ", Mario Balotelli, cầu thủ người Ý đã ghi cả 2 bàn thắng vào lưới đội tuyển Đức nói, sau khi trận đấu tại sân vận động quốc gia Ba Lan khép lại. Màn ăn mừng độc đáo của anh sau đó trở thành meme nổi tiếng trên mạng xã hội.
Phía bên kia Đại Tây Dương, tại vịnh San Francisco ở múi giờ -7, tiến sĩ Jennifer Doudna lặng lẽ rời phòng nghiên cứu để về nhà. Ít người biết, nhà nghiên cứu hóa sinh Đại học California, Berkeley cũng đã có một trong những ngày tuyệt vời nhất sự nghiệp của mình.
Nghiên cứu của cô với những DNA cuối cùng cũng đã được tạp chí khoa học danh tiếng Science xuất bản - dù chẳng có tờ báo phổ thông nào đưa tin về nó. Các phóng viên có lẽ nghĩ rằng một nghiên cứu về vi khuẩn trong ống nghiệm thì không đáng trở thành tin tức. Hoặc đơn giản là tiêu đề bài báo đã không đủ hấp dẫn.
" Tôi nghĩ rằng, nếu tôi viết bài báo ấy ngày hôm nay, tôi sẽ chọn một tiêu đề khác ", tiến sĩ Doudna nói. Mặc dù nghiên cứu của cô chỉ tập trung vào một phương pháp can thiệp gen liên quan đến vi khuẩn, nhưng nó sẽ sớm trở thành một công cụ chỉnh sửa gen cho thực vật, động vật và cả con người.
" Khi chúng tôi xuất bản bài báo này, tôi nhớ mình đã suy nghĩ rất kỹ. Tôi nghĩ nó sẽ trở thành phát súng bắn vào không trung, để báo hiệu cho một cuộc đua mới xuất phát ", tiến sĩ Doudna nói.
Thời gian đã chứng minh linh cảm của tiến sĩ Doudna là đúng. Trên thực tế, thế giới ngày 28/6/2021 đã bỏ lỡ một tin tức vô cùng quan trọng, một bài báo sẽ trở thành giải Nobel, một thử nghiệm kiến tạo nên kỷ nguyên mới" như ủy ban năm 2020 đã tuyên bố." data-rel="follow" target="_blank">" một thử nghiệm kiến tạo nên kỷ nguyên mới " như ủy ban năm 2020 đã tuyên bố.
Đó là một phát hiện sẽ thay đổi toàn bộ cách mà các nhà nghiên cứu sinh học tìm hiểu về sự sống, từ những đoạn mã code đang cấu thành nên cơ thể chúng ta và mọi sinh vật có mặt trên hành tinh.
Thứ mà chúng ta đang nói đến chính là CRISPR.
CRISPR là từ viết tắt của " Clustered Regular Interspaced Short Palindromic Repeats" , nghĩa là " những cụm ngắn xen kẽ và lặp lại thường xuyên " trên bộ gen. Nó lần đầu tiên được quan sát thấy trên vi khuẩn vào năm 1987, bởi một nhà sinh vật học người Nhật tên là Yoshizumi Ishino.
Ishino đã vô tình nhân bản và phát hiện ra những đoạn CRISPR trong bộ gen của vi khuẩn E. coli. Mặc dù nhận ra sự hiện diện kỳ lạ của chúng - những đoạn gen nhỏ này cứ lặp đi lặp lại một cách bất thường - nhà khoa học người Nhật không biết công dụng chính xác của chúng là gì?
Phải mất tới 2 thập kỷ nghiên cứu, vào năm 2008, các nhà khoa học mới có thể khám phá ra chức năng có giá trị đầu tiên của CRISPR. Hóa ra, các đoạn lặp CRISPR này là một cơ chế miễn dịch của vi khuẩn đối với virus.
Đúng vậy, vi khuẩn cũng có thể bị nhiễm virus và nếu không phát triển cho mình một hệ thống miễn dịch, vi khuẩn hoàn toàn có thể bị virus giết chết. Các đoạn CRISPR trong bộ gen của vi khuẩn chính là cơ chế phòng thủ của chúng.
CRISPR thực chất là các đoạn mã gen rất ngắn mà vi khuẩn "sưu tầm" được từ RNA hoặc DNA của virus nó từng nhiễm. Vi khuẩn tích hợp những đoạn CRISPR này vào bộ gen của mình, để lần tới, khi bị nhiễm lại cùng một chủng virus hay virus có mã gen tương tự, nó có thể nhận ra chúng.
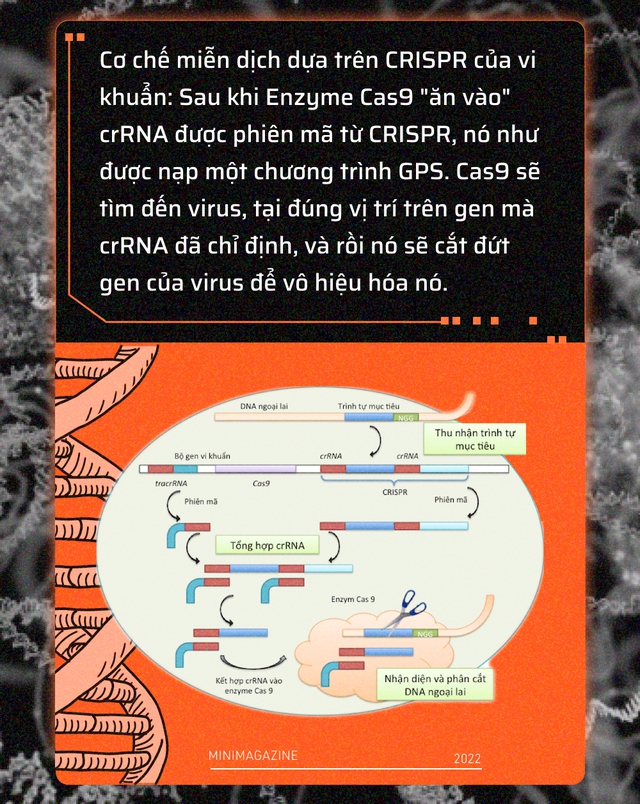
Sau đó, vi khuẩn sẽ dùng những đoạn CRISPR để phiên mã ra một đoạn RNA đặc biệt được gọi là crRNA. Bởi phiên mã là một quá trình phản chiếu, crRNA giống như ảnh trong gương của CRISPR, nó mang toàn bộ thông tin của virus cần tiêu diệt.
Bước tiếp theo, vi khuẩn sẽ sinh ra một enzyme được gọi là Cas9, enzyme này hoạt động giống như một chiếc kéo cắt DNA. Sau khi " ăn vào " crRNA, Cas9 như được nạp một chương trình GPS, nó sẽ tìm đến virus, tại đúng vị trí trên gen mà crRNA đã chỉ định, Cas9 sẽ thực hiện cú cắt của nó.
Càng có nhiều đoạn CRISPR, vi khuẩn càng có nhiều crRNA và enzyme Cas9 của nó càng có khả năng cắt tan tành bộ gen của virus, để vô hiệu hóa khả năng gây bệnh của chúng.
Về cơ bản, bạn có thể hình dung CRISPR/Cas9 của vi khuẩn hoạt động giống như chức năng " Find and Replace " trong Microsoft Word. Vậy nên trong nghiên cứu của mình năm 2012, tiến sĩ Doudna đã tự hỏi:
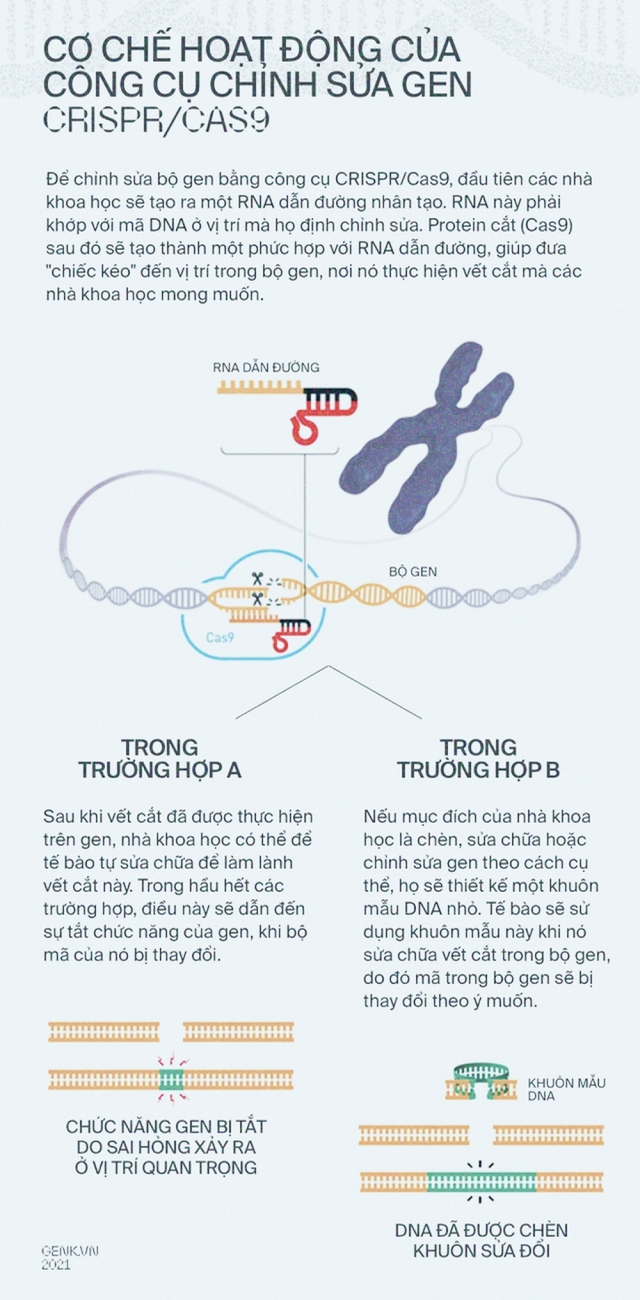
Liệu cô có thể sử dụng CRISPR/Cas9 để cắt bất cứ một DNA nào hay không? Chẳng phải chỉ cần cung cấp cho enzyme Cas9 một crRNA dẫn đường tới DNA đó là được hay sao?
Ý tưởng đã được tiến sĩ Doudna kiểm tra cùng với tiến sĩ Emmanuelle Charpentier, một nữ nhà khoa học người Pháp. Bộ đôi đã tạo ra các đoạn crRNA kết hợp với Cas9 để cắt được các DNA mục tiêu trong ống nghiệm.
Họ công bố nghiên cứu của mình trên tạp chí Science vào ngày 28 tháng 6 năm 2012.
Video đang HOT
Kể từ đó, kết quả nghiên cứu của Doudna nhanh chóng được các nhà khoa học khác dịch từ ống nghiệm sang vi khuẩn, từ vi khuẩn sang tế bào động vật và từ tế bào động vật sang tế bào người.
Các thao tác cũng được mở rộng, không chỉ dừng lại ở việc cắt để vô hiệu hóa gen, các nhà khoa học còn có thể tạo ra các cơ chế cho phép " dán " những mã gen mới vào đúng vị trí mà CRISPR/Cas9 đã cắt.
Bây giờ, nếu bạn hình dung bộ gen của một sinh vật giống như một văn bản với hàng tỷ ký tự (A,C,G,T), thì CRISPR/Cas 9 sẽ giống như một con trỏ chuột, cộng với một trình soạn thảo có đủ tất cả các tổ hợp "Delete", "Ctrl X", "Ctrl C", "Ctrl V".
Với CRISPR, chúng ta đã nắm trong tay một công cụ có thể thay đổi bất kỳ, hoặc thậm chí toàn bộ các mã gen tạo nên sự sống. Một kỷ nguyên mới đã bắt đầu kể từ đó.
Ánh nắng giữa trưa hắt qua khung cửa sổ của Bệnh viện nhi Standford, California nước Mỹ. Trong một căn phòng vô trùng và trên một chiếc giường quá khổ, David Sanchez, 15 tuổi, đang nằm ngủ giữa một mớ dây dợ và ống truyền.
Một trong số đó được cắm thẳng vào tĩnh mạch trước ngực cậu bé, chiếc ống nối với một cỗ máy lọc máu, đang hút những tế bào hồng cầu của Sanchez ra ngoài, loại bỏ chúng và truyền trở lại cho cậu những tế bào hồng cầu khác, được lấy từ người hiến tặng.
Mỗi tháng một lần, Sanchez đều phải đến bệnh viện nhi Stanford để lọc và truyền máu như vậy. Đó là bởi cậu bé đã không may sinh ra với bệnh hồng cầu hình liềm, một chứng rối loạn bẩm sinh đang ảnh hưởng tới 100 triệu người trên thế giới.
" Em không biết tại sao, nhưng có vẻ những tế bào máu của em không thích em cho lắm", Sanchez nói.
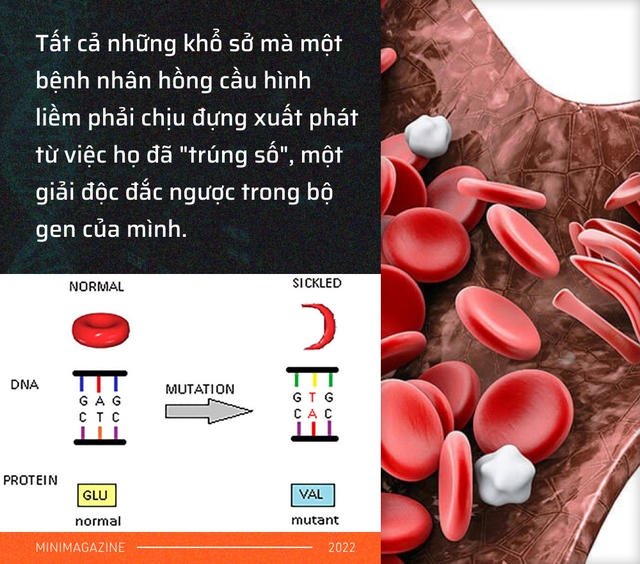
" Bình thường, các tế bào hồng cầu của mọi người đều có hình tròn và chúng vận chuyển oxy trên đó. Nhưng hồng cầu của em thì lại có hình liềm, nó giống như một mặt trăng khuyết. Đó là lý do tại sao bệnh của em được gọi với cái tên như vậy. Vì là một mặt trăng khuyết, hồng cầu của em không mang đủ oxy tới mọi tế bào trên cơ thể".
Hậu quả của việc thiếu oxy là gì? Tất cả các tế bào, các mô và các cơ quan trong cơ thể cậu bé đều có khả năng bị hư hại. Chúng sẽ ngừng hoạt động nếu Sanchez không tới bệnh viện để truyền máu.
Ngoài ra, khi những tế bào hồng cầu hình liềm chảy trong mạch máu, chúng có thể bị mắc vào bất cứ vị trí nào. Một khi những tế bào hình liềm bị mắc lại, chúng lại ngoắc vào các tế bào khác và tạo thành một nút chẹn trong mạch.
Bệnh nhân sau đó sẽ phải chịu những cơn đau tột độ, kéo dài từ vài tiếng cho đến vài ngày. Cùng với đó là những vết sưng, vết loét và nhiễm trùng thường xuyên xuất hiện. Nếu mạch máu cung cấp cho mắt bị chặn lại, Sanchez có thể bị mù lòa. Nếu đó là một mạch máu trong não, cậu có thể bị đột quỵ.
Hiện tại, tuổi thọ trung bình của những bệnh nhân hồng cầu hình liềm chỉ ở khoảng 42-47 tuổi. Càng về cuối đời, chất lượng sống của họ càng suy giảm, cùng với những năm tháng phải lọc máu thường xuyên hơn, chịu đựng những cơn đau dữ dội hơn và cả nguy cơ đột quỵ, suy nội tạng.
Tất cả những khổ sở mà một bệnh nhân hồng cầu hình liềm như Scanchez phải chịu đựng xuất phát từ việc họ đã "trúng số", một giải độc đắc trong bộ gen của mình, chỉ có điều đó là một giải thưởng tồi tệ.
Mọi chuyện xảy ra khi 1 trong số 6,4 tỷ ký tự trong bộ gen của họ, thay vì là chữ cái A đã bị chuyển đổi nhầm thành T. Và nó xảy ra ngay trên gen tạo ra hemoglobin, 1 trong số 20.000 gen của chúng ta, có trách nhiệm tạo ra những tế bào hồng cầu tròn trịa.
" Bệnh hồng cầu hình liềm là một rối loạn gen. Nên nếu bạn muốn chữa nó, bạn phải đi vào bên trong gen và sử dụng một liệu pháp gen" , Tshaka Cunningham, giám đốc điều hành Viện nghiên cứu di truyền Faith Based cho biết.
Trong nhiều năm trước khi CRISPR được phát minh, các nhà khoa học dã có trong tay một vài công cụ chỉnh sửa gen khác. Có thể kể đến như TALEN và ZFNs, hai phương pháp sử dụng protein gắn DNA đặc hiệu. Tuy nhiên, nhược điểm của các phương pháp này là chúng rất phức tạp và khó sử dụng.
TALEN và ZFNs yêu cầu các nhà khoa học phải thiết kế một protein chỉnh sửa gen từ đầu, đặc hiệu cho mỗi lần sửa một DNA cụ thể. Quá trình chuẩn bị này đôi khi mất tới cả tháng trời, đặc biệt là với ZFNs.
CRISPR thì khác, cùng một phân tử Cas9, các nhà khoa học có thể dùng nó để cắt bất cứ trình tự nào, với các mẫu crRNA dẫn đường dễ tổng hợp hơn nhiều. Các kỹ thuật chỉnh sửa gen CRISPR đơn giản đến nỗi bây giờ, một phòng thí nghiệm ở một nước thu nhập thấp cũng có thể thực hiện được.
TALEN và ZFNs cũng có nhược điểm là chúng thường cắt chệch mục tiêu, gây ra đột biến hoặc phát sinh độc tố. Trong so sánh, kỹ thuật CRISPR hiện tại có thể đạt tới độ chính xác đến mức nó có thể thay đổi từng ký tự một trong bộ gen - điều kiện cần và đủ để chữa trị bệnh hồng cầu hình liềm cho Sanchez.
Ý tưởng của phương pháp là các bác sĩ sẽ trích xuất các tế bào gốc tạo máu ở trong tủy của bệnh nhân, sau đó chỉnh sửa gen của chúng bằng CRISPR để thay đổi ký tự T trở lại thành ký tự A, tại đúng vị trí nơi mà đột biến đã xảy ra.
Sau đó, họ nhân bản các tế bào gốc tạo máu này lên hàng triệu lần, tạo thành một túi dịch để truyền trở lại tủy sống cho bệnh nhân. Nhưng trước khi được truyền trở lại, các bệnh nhân hồng cầu hình liềm cần trải qua một đợt hóa trị để tiêu diệt phần lớn các tế bào tạo máu bị lỗi.
Chỉ cần thay thế được khoảng 20% các tế bào lỗi này bằng tế bào chỉnh sửa gen với CRISPR, chúng sẽ giúp các bệnh nhân như Sanchez tạo ra tới 70% lượng hồng cầu khỏe mạnh.
Vào ngày 12 tháng 6 vừa rồi, một nhóm các nhà nghiên cứu từ CRISPR Therapeutics và Vertex, một công ty công nghệ sinh học có trụ sở tại Boston, đã trình bày kết quả một thử nghiệm lâm sàng trên 31 bệnh nhân hồng cầu hình liềm.
Sau khi sử dụng một liệu pháp chỉnh sửa gen bằng CRISPR, cả 31 bệnh nhân này đều đã duy trì được lượng hồng cầu khỏe mạnh. Không một ai trong số họ gặp phải triệu chứng sụt giảm oxy và phải đến bệnh viện nữa.
Thử nghiệm của Vertex cũng giúp chữa trị cho 42/44 bệnh nhân mắc một rối loạn tương tự gọi là hội chứng tan máu. CRISPR Therapeutics và Vertex dự kiến sẽ nộp đơn cho Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) để phê duyệt phương pháp điều trị này vào cuối năm nay. Đó sẽ là một cơ hội rất lớn cho những bệnh nhân như Sanchez có thể chữa khỏi triệt để căn bệnh của mình.
Không lâu sau khi bài báo của tiến sĩ Doudna được công bố, Lukas Dow, một nhà sinh học ung thư tại Weill Cornell Medicine, là một trong số ít người nhìn thấy được tiềm năng của CRISPR từ rất sớm.
" Đọc các bài báo ấy, tôi chỉ có thốt lên một từ là tuyệt vời ", anh nhớ lại. Về mặt lý thuyết, CRISPR có thể được sử dụng để thay đổi bất cứ DNA của bất cứ sinh vật nào. Đối với thực vật, đó là cơ hội để con người có được các loại cây trồng cho năng suất và chất lượng cao hơn.
Công việc này đã và đang được thực hiện tại Inari Agricultural, một công ty công nghệ nông nghiệp có trụ sở ở Cambridge. Inari Agricultural đang dùng CRISPR để chỉnh sửa gen một giống đậu nành sử dụng ít nước và phân bón hơn.
Tại Viện nghiên cứu Nông nghiệp Quốc gia Pháp, các nhà khoa học cũng đang dùng kỹ thuật chỉnh sửa gen này để tạo ra các giống cây chống chịu được với hạn hán và các điều kiện khắc nghiệt.
Các đồng nghiệp của họ tại Anh thì đang dùng CRISPR để lai tạo một loại cà chua có thể sản xuất vitamin D.
Kevin Pixley, một nhà khoa học thực vật tại Trung tâm Cải tiến Ngô và Lúa mì Quốc tế ở Mexico City, nói rằng CRISPR đóng góp rất lớn vào quá trình nhân giống cây trồng, không chỉ vì nó mạnh mẽ, chính xác mà còn vì nó tương đối rẻ.
Ngay cả các phòng thí nghiệm nhỏ ở các quốc gia nghèo cũng có thể tạo ra các loại chuối kháng bệnh hoặc chuối chịu hạn. Các nghiên cứu như thế này có thể mang lại lợi ích cho các quốc gia thu nhập thấp, khi các công ty đang tìm kiếm lợi nhuận tài chính thì thường không để ý tới các thị trường nhỏ.
Chỉnh sửa gen trên động vật cũng sẽ mang lại những lợi ích tương tự cho ngành chăn nuôi. Từ năm 2014, sau khi CRISPR lần đầu tiên được áp dụng trên tế bào động vật, đã có hơn 500 nghiên cứu được xuất bản sử dụng phương pháp này để chỉnh sửa gen các loại vật nuôi từ lợn, cừu, cho đến dê.
Mục đích của chỉnh sửa gen vật nuôi vẫn là để tăng năng suất, giúp động vật chống chịu lại được bệnh tật, các bệnh truyền nhiễm và thậm chí là khiến chúng trở nên " xanh " hơn.
Ngành công nghiệp chăn nuôi hiện đang đóng góp tới 18% tổng lượng khí thải nhà kính mà con người tạo ra. Các nhà khoa học cho biết, bằng cách thay đổi bộ gen của động vật, họ có thể khiến các loài gia súc tạo ra ít metan và nitơ oxyt trong đường ruột và trong phân của chúng hơn. Từ đó, CRISPR sẽ giúp chúng ta có một nền nông nghiệp xanh hơn và thân thiện với môi trường, trong khi vẫn đảm bảo nuôi sống một hành tinh với dân số không ngừng tăng lên.
Tuy nhiên, tâm điểm của những ứng dụng CRISPR vẫn là để chỉnh sửa gen trên con người. Hãy trở lại với bệnh hồng cầu hình liềm mà cậu bé Sanchez mắc phải. Trên thực tế, đó chỉ là một trong số 10.000 căn bệnh di truyền gây ra bởi một đột biến ký tự duy nhất trong bộ gen người. Con số này chiếm tới 60% tổng các bệnh di truyền mà chúng ta biết tới.
CRISPR mở ra cơ hội cho chúng ta chữa khỏi tất cả các căn bệnh đó. Các thử nghiệm trên người và động vật cho thấy trước mắt, phương pháp này đã chữa khỏi được các bệnh như chứng tan máu, bệnh máu khó đông, bệnh xơ nang, chứng loạn dưỡng cơ Duchenne, bệnh Huntington, bệnh amyloidosis transthyretin và thậm chí cả ung thư.
Tại KSQ Therapeutics, một công ty công nghệ sinh học ở Cambridge, các nhà khoa học đang sử dụng CRISPR để phát hiện ra một gen cần thiết cho sự phát triển của khối u. Năm ngoái, họ đã bắt đầu thử nghiệm lâm sàng một loại thuốc ngăn chặn gen này.
Caribou Biosciences là một công ty khởi nghiệp sinh học khác được sáng lập bởi chính tiến sĩ Doudna. Họ cùng với CRISPR Therapeutics, đồng sáng lập bởi tiến sĩ Charpentier đều đang chạy thử nghiệm lâm sàng một phương pháp điều trị CRISPR chống ung thư bằng liệu pháp miễn dịch.
Mục tiêu là chỉnh sửa các tế bào miễn dịch của con người để chúng có khả năng tấn công khối u ung thư mạnh mẽ hơn.
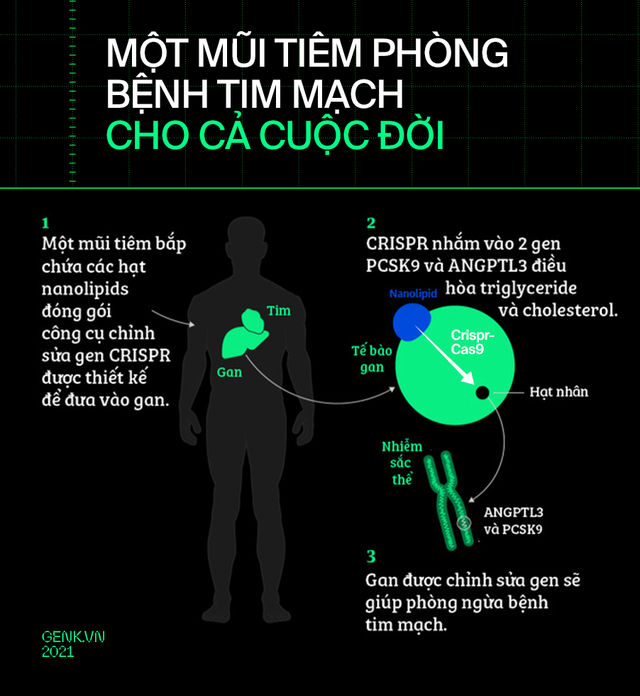
Đại học Stanford trong những năm gần đây cũng đang chạy một dự án được gọi là ELITE. Họ nhắm đến việc chỉnh sửa 2 gen điều hòa mỡ máu và cholesterol trong gan để giúp một số bệnh nhân có nguy cơ mắc bệnh tim mạch cao phòng bệnh.
Dự kiến phương pháp này sẽ được thử nghiệm trên người vào năm 2026.
CRISPR cũng đang thể hiện tiềm năng của mình trong một loạt các căn bệnh khác, từ HIV, tiểu đường type 1 cho đến bệnh nhiễm trùng. Trong những năm gần đây, các nhà khoa học đã thả những con muỗi được chỉnh sửa gen bằng CRISPR để trở nên vô sinh vào môi trường, nhằm hạn chế các bệnh truyền nhiễm do muỗi gây ra.
Nhưng tác động của CRISPR còn vượt ra khỏi bên ngoài lĩnh vực y học. Ý tưởng là: Nếu bạn có thể dùng CRISPR để tắt một gen, bạn sẽ biết được chức năng của gen đó khi nó không biểu hiện.
CRISPR vì vậy có thể được sử dụng như một công cụ nghiên cứu, để tìm hiểu mọi bí ẩn của mọi sinh vật sống. Ví dụ, các nhà sinh học tiến hóa đang sử dụng công nghệ này để nghiên cứu bộ não của người Neanderthal, và điều tra xem tổ tiên loài vượn của chúng ta đã mất đuôi như thế nào? Một số còn sử dụng CRISPR để hồi sinh voi ma mút.
Khả năng ứng dụng gần như vô biên của CRISPR còn được thể hiện ở chỗ, bây giờ nó đã được dùng gần như một động từ. Thay vì nói chỉnh sửa gen bằng CRISPR, mọi người chỉ đơn giản nói " Anh đã CRISPR nó ư? ", tiến sĩ Dow cho biết.
Các nhà phân tích y tế dự đoán thập kỷ tới sẽ là thập kỷ bùng nổ của các ứng dụng CRISPR , khi công nghệ này đã phát triển chín muồi để nhận được sự đầu tư của những ông lớn trong ngành dược phẩm, những Big Pharma.
Phát súng đầu tiên đã được nổ bởi Pfizer khi gã khổng lồ dược phẩm Mỹ cam kết một khoản đầu tư trị giá 1,35 tỷ USD với Beam Therapeutics, một công ty spin-off từ phòng thí nghiệm của giáo sư David Liu và các đồng nghiệp tại Viện Broad và Viện Công nghệ Massachusetts.
Beam Therapeutics được định giá lên tới 4,8 tỷ USD và đang sở hữu những kỹ thuật chỉnh sửa gen CRISPR nhắm đến việc điều trị một lần và dứt điểm hàng chục căn bệnh di truyền.
Hai gã khổng lồ dược phẩm khác là Sanofi và GlaxoSmithKline cũng đang phát triển các chương trình nghiên cứu RNA, và giới chuyên gia nhận định họ có thể chuyển các chương trình đó thành CRISPR bất cứ lúc nào.
" Tôi nghĩ rằng chỉnh sửa gen sẽ sớm trở thành một điều gì đó hiển nhiên ", Giuseppe Ciaramella, giám đốc khoa học của Beam Therapeutics cho biết. Nghĩa là bạn sẽ sớm có thể tới một bệnh viện, hoặc thậm chí một phòng khám tư nhân và nói " Tôi muốn CRISPR".
"With great power comes great responsibility" - "Sức mạnh lớn lao đi kèm với trách nhiệm lớn lao ". Trong khi tiến sĩ Doudna thừa nhận CRISPR đã cách mạng hóa hiểu biết của con người về thế giới tự nhiên, cô cũng mường tượng được một viễn cảnh hết sức tồi tệ nếu phát minh của mình bị lạm dụng sai mục đích.
Ngay sau khi bài báo của tiến sĩ Doudna được xuất bản, đêm đó về nhà và nằm xuống, cô đã mơ thấy Adolf Hitler. Không phải không có logic nào đằng sau cơn ác mộng ấy của tiến sĩ Doudna.
Trong thế kỷ 19, Đức Quốc Xã chính là cái nôi của một học thuyết được gọi là " thuyết ưu sinh ". Hitler coi người Đức là một nhóm dân tộc thượng đẳng, có ưu thế về mặt di truyền so với các dân tộc khác. Vì vậy, logic của hắn là: Để có được một loài người tốt hơn, những người " thấp kém" như Do Thái nên bị tiêu diệt và xóa sổ.
Đây được gọi là thuyết ưu sinh theo trường phái cũ, nó đã dẫn tới cuộc đại diệt chủng Holocaust, trong đó, Đức Quốc xã đã giết chết 6 triệu người Do Thái và hơn 5 triệu người thuộc các dân tộc khác.
Sau khi Hilter chết, Đức Quốc Xã tan rã. Nhưng các mầm mống của thuyết ưu sinh vẫn tồn tại, và thậm chí còn phát triển thành một trường phái mới. Thuyết ưu sinh mới cho rằng:
Tất cả những gì cần thiết để xây dựng một giống loài tốt đẹp hơn là khuyến khích những cá thể cao cấp trong từng nhóm sắc tộc sinh ra nhiều trẻ em hơn, ngược lại, ngăn cản những người mang trên mình đặc điểm thấp kém sinh sản.
Những tiến bộ khoa học, đặc biệt là trong lĩnh vực DNA tiếp tục nâng tầm thuyết ưu sinh lên một đỉnh cao về mặt ý tưởng. Câu chuyện lúc này trở thành: Liệu con người có thể tự chỉnh sửa gen của mình để trở thành những con người mới ưu việt hơn hay không?
Ý tưởng này chỉ đơn giản là một thử nghiệm trong suy nghĩ, cho đến năm 2018, khi He Jiankui, một nhà lý sinh ở Trung Quốc, đã chỉnh sửa một gen trong phôi thai người để tạo ra ít nhất 3 đứa trẻ được cho là có khả năng miễn nhiễm với virus HIV.
"Thật khó để giải thích cảm xúc của tôi khi nhìn thấy điều đó. Đó là một cảm giác kinh hoàng, bởi vì đây là viễn cảnh mà chúng tôi [cộng đồng khoa học] đã nghĩ đến và cố gắng hết sức để ngăn chặn, nhưng bây giờ nó đã thực sự xảy ra ", tiến sĩ Doudna nói.
Trong khi bạn có thể nghĩ, giúp những đứa trẻ sinh ra với khả năng miễn nhiễm HIV là một điều tốt, các nhà khoa học như tiến sĩ Doudna luôn muốn ngăn chặn " ý định tốt đẹp đó ". Họ so sánh nó với một con dốc trơn trượt, nơi bạn chỉ cần bước qua một điểm khởi đầu, nó sẽ dẫn tới một chuỗi các sự kiện domino. Cuối cùng, mọi thứ sẽ tuột dốc không phanh tới đáy vực.
Ở đó, thí nghiệm của He Jiankui có thể được so sánh với quả tên lửa hạt nhân đầu tiên được phóng lên không trung. Nó có thể kích hoạt cả một cuộc chạy đua vũ trang và chiến tranh nguyên tử trên toàn thế giới.
John Evans, một giáo sư xã hội học tại Đại học California San Diego, Hoa Kỳ, người đã theo dõi quá trình phát triển của kỹ thuật chỉnh sửa gen người, cho biết:
" Đối với công nghệ chỉnh sửa gen người, con dốc trơn trượt luôn có đỉnh là một hành động chỉnh sửa gen được coi là có đạo đức và không thể chối cãi - một bước mà hầu hết mọi người sẵn sàng thực hiện - chẳng hạn như chỉnh sửa gen để chữa bệnh thiếu máu hồng cầu hình liềm ở trẻ sơ sinh.
Tuy nhiên, đối mặt với một con dốc trơn trượt, rất khó để nói rằng việc thay đổi các đặc điểm khác không dẫn đến hậu quả chết người. Một khi bạn tìm ra cách thay đổi một gen, bạn có thể thay đổi bất kỳ gen nào, bất kể chức năng nào của nó ".
Nếu chúng ta chỉnh sửa gen để chữa được bệnh hồng cầu hình liềm hoặc ngăn ngừa HIV, tại sao làm điều đó để chữa bệnh điếc, hoặc bệnh tim khởi phát muộn, hoặc đem trí tuệ đến cho những đứa trẻ thiểu năng, rồi khiến cả những đứa trẻ bình thường trở nên thông minh hơn?
Đó cũng chính là những gì mà Stephen Hawking đã dự báo t rong tác phẩm cuối cùng của cuộc đời mình : " Brief Answers to the Big Questions " (tạm dịch Lời đáp gọn cho những câu hỏi lớn). Cuốn sách chứa đựng những tâm tư cuối đời của Hawking cho những câu hỏi mà nhân loại đang phải đối mặt.
"Chúng ta đang bước vào một giai đoạn mới của những gì được gọi là tiến hóa tự thiết kế, trong đó, chúng ta có khả năng thay đổi và cải thiện DNA ", Hawking viết. " Bây giờ chúng ta đã lập được bản đồ DNA, nghĩa là đã đọc được "cuốn sách của sự sống", vì vậy chúng ta có thể bắt đầu viết lại nó theo cách chúng ta cho là đúng".
Ở thời điểm ban đầu, năng lực này sẽ bị " giới hạn trong việc sửa chữa các khuyết tật di truyền ". Nhưng theo thời gian, chúng ta sẽ tiến đến chỗ thay đổi cả các gen bình thường, từ đó mở ra khả năng tạo ra những con người siêu việt.
Và đó chính xác là nơi mà thuyết ưu sinh bắt đầu sống lại.
"Tôi chắc chắn trong thế kỷ này, con người sẽ khám phá ra cách sửa đổi trí thông minh và cả những bản năng ví dụ như tính hiếu chiến ", Hawking viết. "Có thể sẽ có những bộ luật được thông qua để chống lại kỹ thuật chỉnh sửa gen trên người. Nhưng rồi một số sẽ không thể cưỡng lại sự cám dỗ của việc cải thiện những đặc tính của con người, chẳng hạn như giới hạn của trí nhớ, sức đề kháng với bệnh tật và tuổi thọ".
Hawking nghi ngại điều này sẽ tạo ra chỉ một nhóm nhỏ người ưu tú, mà ông gọi họ là " superhumans ". Những " siêu nhân " này sẽ thúc đẩy sự bất bình đẳng, dẫn đến xung đột với con người bình thường.
"Một khi các siêu nhân như vậy xuất hiện, sẽ có những vấn đề chính trị hệ trọng đặt ra với những con người bình thường không được nâng cấp, những người này sẽ không thể cạnh tranh được với họ ", ông gợi ý.
" Có lẽ, họ sẽ chết, hoặc trở thành những sinh vật không quan trọng. Thay vào đó, sẽ có một cuộc đua của những sinh vật tự thiết kế liên tục để cải thiện bản thân với tốc độ ngày càng nhanh".
Và đó là lý do tại sao nghiên cứu của He Jiankui bị cộng đồng các nhà khoa học quốc tế và cả các nhà khoa học Trung Quốc lên án . Nó đã vượt qua cả nguyên tắc đạo đức khoa học và pháp luật.
Trên thực tế, thử nghiệm CRISPR mà Jiankui thực hiện trên những phôi thai người còn chưa được thực hiện thành công trên động vật. Các rủi ro liên quan đến sức khỏe của những phôi thai và tuổi thọ của những đứa trẻ chưa hề được kiểm soát.
" Thí nghiệm đó đã mang Mengele trở lại ", tiến sĩ Doudna nói, đề cập đến Josef Mengele, một sĩ quan bác sĩ dưới thời Đức Quốc Xã được mệnh danh là " thiên thần chết" , người đã liên tục thực hiện nhiều thí nghiệm trên các tù nhân tại trại tập trung Auschwitz.
Tất nhiên, He Jiankui đã bị trừng phạt. Cuối năm 2019, một toà án cấp huyện ở Trung Quốc đã kết án He Jiankui 3 năm tù cho " hành vi hoạt động y tế bất hợp pháp ". Nhưng đến tháng 4 năm nay, có thông tin cho biết ông ấy đã được trả tự do.
Ngược lại, chúng ta không được nghe gì nhiều về sức khỏe của 3 đứa trẻ CRISPR trong thí nghiệm. Tất cả đến bây giờ đã đang ở độ tuổi chập chững biết đi.
Giống như một nhà khoa học nhỏ bé vô tình mở ra chiếc hộp Pandora, tiến sĩ Doudna ban đầu cảm thấy cô không có sức mạnh để giải quyết những tác động xã hội và đạo đức mà CRISPR đặt ra.
" Ở đây, chúng ta đang ngồi trên một nền tảng công nghệ mạnh mẽ đến nhường nào. Ngày càng có nhiều nhà khoa học sử dụng nó. Nhưng hầu hết những người không hoạt động trong lĩnh vực khoa học không biết về nó và những gì mà nó có thể làm được ", tiến sĩ Doudna nói.
"Vậy thì tôi phải làm gì bây giờ? Gọi cho Thượng nghị sĩ của tôi ư? Tôi không chắc mình có thể làm được gì. Tôi cũng không có ai để tham vấn" .
Trách nhiệm và những trăn trở cuối cùng cũng giúp tiến sĩ Doudna tìm ra một giải pháp. Cô đã tìm đến những người đoạt giải Nobel khác - bao gồm David Baltimore, nhà khoa học người Mỹ cũng đã phải vật lộn với những câu hỏi đạo đức tương tự sau khi ông khám phá ra cách điều khiển DNA tổ hợp lại các trình tự của nó - một phiên bản chỉnh sửa gen thô sơ từng giúp phát triển nhiều loại thuốc và vắc-xin tiềm năng.
Với sự giúp đỡ của Baltimore và các nhà khoa học khác, tiến sĩ Doudna đã soạn thảo ra một bản hướng dẫn sử dụng CRISPR có trách nhiệm, tuân thủ luật pháp cũng như sự đồng thuận về đạo đức khoa học.
Tuy nhiên, cô hiểu được rằng một bản hướng dẫn không có sức mạnh về mặt pháp lý. Ở đâu đó sẽ có những nhà khoa học cố tình không tuân thủ nó, như cách mà He Jiankui đã làm.
Vì vậy, bước tiếp theo trong việc kiểm soát CRISPR phải đến từ dư luận và các cơ sở pháp lý. Công chúng, tòa án và các quốc gia, các tổ chức quốc tế phải trở thành là những người gác cổng cho công nghệ chỉnh sửa gen này.
Điều đó cũng có nghĩa là mọi người đều phải nhận thức được sức mạnh của nó, giống như cách mà chúng ta nhận ra tính hai mặt của công nghệ hạt nhân.
Ở một phía, năng lượng từ những nguyên tử có thể được khai thác trong những nhà máy để thắp sáng hành tinh của chúng ta. Nhưng ở phía còn lại, nó cũng có thể được biến thành những vũ khí hủy diệt như bom nguyên tử.
" Vậy nên, chúng ta đang phải đi tìm con đường phát triển CRISPR một cách đúng đắn, và chúng ta phải tìm cho ra con đường đó ", tiến sĩ Doudna nói.
"Thứ công nghệ này mang trong mình sức mạnh thay đổi cả bản chất của con người, chỉ cần chúng ta muốn là sẽ làm được. Tôi không phải là người theo chủ nghĩa thái quá, nhưng tôi đang cố gắng cảnh báo mọi người rằng: CRISPR rồi sẽ thay đổi mọi thứ".
Tham khảo: Nytimes , Time , NPR , Science , Stanford , Theconversation , Labiotech , Wired
Phạt 66 tháng tù đối tượng tuyên truyền chống phá Nhà nước  Sáng 13/7, TAND tỉnh Hà Tĩnh đã tổ chức phiên toà xét xử sơ thẩm công khai vụ án hình sự đối với bị cáo Nguyễn Đức Hùng, SN 1991, trú tại TDP Ba Đồng, phường Kỳ Phương, thị xã Kỳ Anh, Hà Tĩnh, bị khởi tố về tội "Làm, tàng trữ, phát tán hoặc tuyên truyền thông tin, tài liệu, vật phẩm...
Sáng 13/7, TAND tỉnh Hà Tĩnh đã tổ chức phiên toà xét xử sơ thẩm công khai vụ án hình sự đối với bị cáo Nguyễn Đức Hùng, SN 1991, trú tại TDP Ba Đồng, phường Kỳ Phương, thị xã Kỳ Anh, Hà Tĩnh, bị khởi tố về tội "Làm, tàng trữ, phát tán hoặc tuyên truyền thông tin, tài liệu, vật phẩm...
Tiêu điểm
Tin đang nóng
Tin mới nhất

Tổng hợp các phiên bản trên iPhone 17 Pro, có gì khác năm ngoái?

Lý do Samsung muốn iPhone của Apple 'bán chạy như tôm tươi'

Cận cảnh iPhone 17 Pro Max mạ vàng do nghệ nhân Việt chế tác 33 tiếng liên tục

vivo V60 5G: 'Chuyên gia chân dung' pin bền bỉ và những đánh đổi có chủ đích
iPhone 17 Pro Max vs Galaxy S25 Ultra: Đâu mới là 'ông vua' flagship năm 2025?

Giá iPhone 16 Pro Max, iPhone 16 Pro mới nhất chạm đáy kỷ lục, khi iPhone 17 Pro Max xuất hiện

Hình bóng iPhone gập được hé lộ

Asus ExpertBook P3 trong mắt dân văn phòng: Có đủ thuyết phục?

Nhược điểm của vỏ nhôm trên iPhone 17 Pro

Samsung tái diễn cơn ác mộng bloatware trên Galaxy Tab S11

Cơ hội sở hữu MacBook giá rẻ sắp thành hiện thực

Liệu iPhone 17 Pro có đủ sức hủy diệt smartphone chơi game?
Có thể bạn quan tâm

Điều trị triệt để ung thư nang lông giúp giảm tái phát
Sức khỏe
05:14:20 25/09/2025
Israel: Thành phố Jerusalem lên kế hoạch thu phí ô tô vào nội đô
Thế giới
05:00:03 25/09/2025
Khởi tố thanh niên xâm nhập máy tính người khác đánh cắp dữ liệu
Pháp luật
01:23:41 25/09/2025
Tài xế tử vong nghi do đột quỵ, xe bồn bị mất lái tông vào nhiều xe
Tin nổi bật
01:03:00 25/09/2025
Cả đời chưa thấy phim Hàn nào có cảnh nóng khét đến mức này
Phim châu á
00:22:44 25/09/2025
Chuyện gì vừa xảy ra với gương mặt của Phương Oanh?
Hậu trường phim
00:19:06 25/09/2025
Độc lạ 2025: Người dân dán ảnh Tạ Đình Phong khắp nơi để... chống siêu bão Ragasa
Sao châu á
00:12:41 25/09/2025
Cuộc sống của MC Thanh Bạch sau biến cố sức khỏe
Sao việt
00:01:20 25/09/2025
Chủ doanh nghiệp đến show hẹn hò, chinh phục cô gái ngoài 40 chưa từng kết hôn
Tv show
23:57:25 24/09/2025
19 bài hát không bao giờ được ra mắt của Mỹ Tâm tiết lộ quan hệ bí ẩn với ân nhân làm nên sự nghiệp
Nhạc việt
23:30:34 24/09/2025
 Galaxy Z Flip4 phần bản lề không thay đổi nhưng nếp gấp màn hình đã được xử lý?
Galaxy Z Flip4 phần bản lề không thay đổi nhưng nếp gấp màn hình đã được xử lý? iPhone 13 xanh lá lên kệ tại Việt Nam, máy xách tay giảm giá mạnh
iPhone 13 xanh lá lên kệ tại Việt Nam, máy xách tay giảm giá mạnh






















 Giá Honda SH mới nhất: Tăng đến 10 triệu đồng so với tháng trước
Giá Honda SH mới nhất: Tăng đến 10 triệu đồng so với tháng trước Đi gọi mẹ về ăn cơm, bé trai 7 tuổi bị tông tử vong, gia đình truy tìm người gây tai nạn
Đi gọi mẹ về ăn cơm, bé trai 7 tuổi bị tông tử vong, gia đình truy tìm người gây tai nạn Tạo hứng khởi cho học sinh từ kĩ thuật dạy học hiện đại
Tạo hứng khởi cho học sinh từ kĩ thuật dạy học hiện đại Chuyện nhà ống Hà Nội cao 12 tầng, sâu 100m lên báo danh tiếng Mỹ
Chuyện nhà ống Hà Nội cao 12 tầng, sâu 100m lên báo danh tiếng Mỹ COVID-19 tới 6 giờ sáng 29/3: Hàn Quốc tuyên bố đã qua đỉnh dịch; Những điều cần biết về vaccine cho trẻ dưới 5 tuổi
COVID-19 tới 6 giờ sáng 29/3: Hàn Quốc tuyên bố đã qua đỉnh dịch; Những điều cần biết về vaccine cho trẻ dưới 5 tuổi BXH sức mạnh các đội mới nhất: Faker và SofM "trụ hạng" thành công, ĐKVĐ CKTG 2021 gần đội sổ
BXH sức mạnh các đội mới nhất: Faker và SofM "trụ hạng" thành công, ĐKVĐ CKTG 2021 gần đội sổ
 Cổng sạc của iPhone Air và iPhone 17 có một nhược điểm lớn
Cổng sạc của iPhone Air và iPhone 17 có một nhược điểm lớn Đọ thời lượng pin loạt iPhone 17, iPhone Air và Galaxy S25 Ultra
Đọ thời lượng pin loạt iPhone 17, iPhone Air và Galaxy S25 Ultra Giá iPhone 15, iPhone 15 Pro Max mới nhất siêu rẻ, chạm mốc kỷ lục khi iPhone 17 xuất hiện
Giá iPhone 15, iPhone 15 Pro Max mới nhất siêu rẻ, chạm mốc kỷ lục khi iPhone 17 xuất hiện iPhone 17 quá 'hot', liệu bản Pro có bị ế?
iPhone 17 quá 'hot', liệu bản Pro có bị ế? Galaxy S26 Ultra có 'vũ khí' gì để lật ngược thế cờ từ iPhone 17 Pro Max?
Galaxy S26 Ultra có 'vũ khí' gì để lật ngược thế cờ từ iPhone 17 Pro Max? Hé lộ một nâng cấp sáng giá của Galaxy S26 Ultra để giữ 'ngôi vương'
Hé lộ một nâng cấp sáng giá của Galaxy S26 Ultra để giữ 'ngôi vương' iPhone 17 Pro dễ trầy xước, người dùng cần làm gì?
iPhone 17 Pro dễ trầy xước, người dùng cần làm gì? iPhone màn hình gập có thiết kế giống iPhone Air
iPhone màn hình gập có thiết kế giống iPhone Air Samsung hay Apple thống lĩnh thế hệ màn hình mới tuyệt đỉnh cho smartphone?
Samsung hay Apple thống lĩnh thế hệ màn hình mới tuyệt đỉnh cho smartphone? Sốc: Hương Giang là đại diện Việt Nam thi Miss Universe 2025!
Sốc: Hương Giang là đại diện Việt Nam thi Miss Universe 2025! Diện váy 5 triệu đồng ra mắt mẹ bạn trai, tôi cay đắng khi nhận ra bà là ai
Diện váy 5 triệu đồng ra mắt mẹ bạn trai, tôi cay đắng khi nhận ra bà là ai Công an cảnh báo thủ đoạn dùng nghệ sĩ quảng cáo cờ bạc
Công an cảnh báo thủ đoạn dùng nghệ sĩ quảng cáo cờ bạc Son Ye Jin - Hyun Bin sắp lên chức bố mẹ lần nữa?
Son Ye Jin - Hyun Bin sắp lên chức bố mẹ lần nữa? Thuyết âm mưu bủa vây showbiz Trung Quốc
Thuyết âm mưu bủa vây showbiz Trung Quốc Song Seung Hun và lời chia sẻ cảm động dành cho mẹ
Song Seung Hun và lời chia sẻ cảm động dành cho mẹ Mở rộng vụ án cuốc xe 70 km giá 2,5 triệu đồng, số phận tài xế ra sao?
Mở rộng vụ án cuốc xe 70 km giá 2,5 triệu đồng, số phận tài xế ra sao? Hai người thương vong sau chuyến lặn biển ở độ sâu gần 20m
Hai người thương vong sau chuyến lặn biển ở độ sâu gần 20m Lá thư xúc động bố ca sĩ Đức Phúc gửi Mỹ Tâm và Hồ Hoài Anh
Lá thư xúc động bố ca sĩ Đức Phúc gửi Mỹ Tâm và Hồ Hoài Anh Khó cứu Jeon Ji Hyun: Mất trắng 854 tỷ sau 1 đêm, bị công ty quản lý "mang con bỏ chợ"
Khó cứu Jeon Ji Hyun: Mất trắng 854 tỷ sau 1 đêm, bị công ty quản lý "mang con bỏ chợ" Sự thật về vụ tự tử của người phụ nữ bán rau bị cướp điện thoại
Sự thật về vụ tự tử của người phụ nữ bán rau bị cướp điện thoại Chưa thấy phu nhân tài phiệt nào kém sang thế này: Nhan sắc sến súa lạc quẻ, giọng nói còn tuyệt vọng hơn
Chưa thấy phu nhân tài phiệt nào kém sang thế này: Nhan sắc sến súa lạc quẻ, giọng nói còn tuyệt vọng hơn Chàng trai yêu thầm mẹ của bạn học và cái kết viên mãn sau nhiều năm
Chàng trai yêu thầm mẹ của bạn học và cái kết viên mãn sau nhiều năm Bé gái sơ sinh bị bỏ ở trạm điện cùng tờ giấy ghi tên và 15 triệu đồng
Bé gái sơ sinh bị bỏ ở trạm điện cùng tờ giấy ghi tên và 15 triệu đồng Lời khai của nghi phạm vụ người phụ nữ tử vong sau khi bị cướp điện thoại
Lời khai của nghi phạm vụ người phụ nữ tử vong sau khi bị cướp điện thoại Vợ cũ tiết lộ thông tin bất ngờ về cuộc sống của ông Minh - bà Giao sau khi nhận hơn 1,5 tỷ từ mạnh thường quân
Vợ cũ tiết lộ thông tin bất ngờ về cuộc sống của ông Minh - bà Giao sau khi nhận hơn 1,5 tỷ từ mạnh thường quân Ưng Hoàng Phúc đã có mặt để làm việc với Công an TP.HCM theo thư triệu tập
Ưng Hoàng Phúc đã có mặt để làm việc với Công an TP.HCM theo thư triệu tập Phương Oanh tổ chức sinh nhật ấm áp tình thân cho Shark Bình, thái độ của 2 con riêng nói lên tất cả
Phương Oanh tổ chức sinh nhật ấm áp tình thân cho Shark Bình, thái độ của 2 con riêng nói lên tất cả