Đại gia dược phẩm định kiếm lời từ vaccine Covid-19
Bất chấp các khoản đầu tư trị giá hàng trăm triệu USD từ chính phủ, một số hãng dược vẫn muốn thu lợi nhuận từ vaccine Covid-19.
Bốn hãng dược đang dẫn đầu cuộc đua phát triển vaccine là AstraZeneca, Johnson & Johnson, Moderna Therapeutics và Pfizer. Sau các thử nghiệm lâm sàng giai đoạn một và hai, tất cả đều tỏ ra lạc quan rằng sản phẩm của mình sẽ được ra mắt vào cuối năm nay hoặc đầu năm sau.
Các công ty cũng nhận được khoản đầu tư lên tới hàng trăm triệu USD từ chính quyền các nước, nhằm thúc đẩy quá trình ra mắt vaccine. AstraZeneca và Johnson & Johnson đã cam kết sẽ sản xuất hàng trăm liều tiêm hoàn toàn phi lợi nhuận.
Tuy nhiên, Moderna, đơn vị dẫn đầu cuộc đua, từng nhận khoản tài trợ lên đến 483 triệu USD, từ chối làm điều này.
“Chúng tôi sẽ không bán nó với giá gốc”, Tiến sĩ Stephen Hoge, chủ tịch Moderna, tuyên bố.
Điều này gây ra một cuộc tranh luận giữa các nhà lập pháp. Nhiều người cho rằng số tiền liên bang đổ vào hãng nên bao gồm điều khoản nhằm đảm bảo khả năng chi trả và chống trục lợi từ sản phẩm.
Trụ sở chính của hãng dược Moderna tại Cambridge, Massachusetts. Ảnh: NY Times
Trong phiên điều trần Quốc hội hôm 21/7, một số thành viên Hạ viện bày tỏ quan ngại về việc Pfizer từ chối nhận đầu tư của chính phủ, cho rằng điều này có thể dẫn đến chênh lệch và thiếu minh bạch về giá cả.
Video đang HOT
“Chúng tôi không chấp nhận khoản tài trợ liên bang bởi muốn vaccine đi đến giai đoạn thử nghiệm lâm sàng một cách nhanh chóng nhất. Chúng tôi sẽ định giá sản phẩm dựa trên độ cấp thiết về sức khỏe toàn cầu”, John Young, giám đốc kinh doanh của hãng, nói. Ông cũng khẳng định vaccine sẽ là vô nghĩa nếu nó nằm ngoài khả năng chi trả của người dân.
Trong khi đó, Tiến sĩ Raul Ruiz, đại diện Đảng Dân chủ California, đặt câu hỏi rằng liệu khúc mắc trong khâu giải quyết khoản đầu tư tài chính cho việc phát triển vaccine có khiến sản phẩm không đến được tay những người cần thiết nhất.
“Tôi không muốn để công bằng y tế trở thành một ý tưởng phát sinh. Nó phải được ưu tiên”, ông nói.
Ngày 20/7, cả AstraZeneca và Pfizer đều công bố dữ liệu sơ bộ, cho thấy vaccine có thể kích thích phản ứng miễn dịch mạnh mẽ, để lại tác dụng phụ không đáng kể. Tuy nhiên, thời gian duy trì kháng thể vẫn chưa được xác định. Đến nay, chưa “ứng viên” nào chứng minh được hiệu quả trong việc ngăn ngừa Covid-19, hoặc bảo vệ con người khỏi ảnh hưởng nghiêm trọng của căn bệnh.
Trong phiên điều trần hôm 21/7, thành viên Hạ viện đã kêu gọi giám đốc điều hành các công ty duy trì cam kết cho ra vaccine với tiêu chuẩn cao nhất, không hy sinh chất lượng để đổi lấy thời gian. Loại vaccine khả thi không chỉ an toàn và hiệu quả, nó phải đủ đơn giản để có thể sản xuất hàng loạt với chi phí thấp.
“Có khả năng vaccine Covid-19 sẽ hoàn thành trong năm nay hoặc đầu năm sau. Đây là tin tốt hiếm hoi trong thời kỳ khó khăn này. Nhưng chúng ta cần tự nhắc nhở bản thân rằng, nhiều điều vẫn có thể đi chệch hướng. Do đó, lịch trình dự kiến còn chưa chắc chắn”, Diana DeGette, đại diện Đảng Dân chủ bang Colorado, cho biết.
“Ứng viên” thứ 5 tại Mỹ đến từ Merck. So với những đối thủ, bức tranh về vaccine của hãng ít “màu hồng” hơn. Tiến sĩ Julie Gerberding, phó chủ tịch điều hành, không đưa ra bất cứ lời hứa hẹn nào về sản phẩm.
“Chúng tôi không hy vọng đẩy nhanh quá trình thẩm định độ an toàn”, ông nói.
Trước đó, Kenneth Frazier, giám đốc điều hành của hãng, từng phản đối việc cường điệu hóa thời gian sản xuất vaccine, cảnh báo quy trình phê duyệt vội vàng có thể phá hủy nỗ lực bảo vệ cộng đồng khỏi mầm bệnh.
Nhà nghiên cứu của Moderna trong quá trình điều chế vaccine Covid-19, tháng 2. Ảnh: NY Times
Trong tuyên bố đưa ra hôm 30/6, Cục Quản lý Thực phẩm và Dược phẩm lưu ý bất cứ “ứng viên” nào được phê duyệt cũng cần ngăn ngừa hoặc cải thiện ít nhất 50% tình trạng của người dùng. Các nhà sản xuất không thể dự đoán số liệu này, cho đến khi thử nghiệm giai đoạn 3 trên hàng nghìn người chính thức diễn ra.
Người đứng đầu các hãng dược cho biết sự chấp thuận từ liên bang không phải mục tiêu cuối cùng trong quá trình phát triển vaccine. Sau khi đạt được cột mốc này, sản phẩm vẫn cần đáp ứng nhu cầu của nhóm dễ ảnh hưởng bởi virus, bao gồm người già, có bệnh lý tiềm ẩn, người da đen, Mỹ Latinh hay bản thổ Mỹ.
Trong tuyên bố bằng văn bản, AstraZeneca , Johnson & Johnson và Pfizer đã tái khẳng định cam kết đa dạng hóa trong việc phân phối vaccine, đảm bảo cả cộng đồng yếu thế nhất cũng tiếp cận và hưởng lợi từ sản phẩm.
Trong khi đó Tiến sĩ Stephen Hoge, chủ tịch Moderna, tuyên bố công ty đang tìm kiếm tình nguyện viên từ nhiều chủng tộc khác nhau ở Mỹ để tiến hành giai đoạn 3. Đơn vị cũng nhấn mạnh tầm quan trọng của việc phân phối các liều tiêm hiệu quả trên toàn thế giới.
“Không ai trong chúng ta an toàn cho đến khi tất cả đều an toàn”, John Young, giám đốc kinh doanh của Pfizer, nói.
Vaccine Covid-19 Mỹ đầu tiên được bình duyệt
Vaccine Covid-19 từ Moderna tiếp tục đạt hiệu quả trong thử nghiệm giai đoạn một, thực hiện độc lập bởi Viện Y tế Quốc gia (NIH).
Kết quả được công bố trên Tạp chí Y khoa New England hôm 14/7, cho thấy vaccine kích hoạt phản ứng miễn dịch đủ để ngăn ngừa nCoV.
Thử nghiệm tiến hành trên 45 người trưởng thành (độ tuổi từ 18 đến 55). Tất cả được tiêm chủng trong thời gian từ ngày 16/3 đến 14/4. Họ chia thành các nhóm, nhận vaccine với liều lượng lần lượt là 25 g, 100 g và 250 g. Các phản ứng phụ nhẹ bao gồm mệt mỏi, ớn lạnh, đau đầu, đau cơ, nhức tại vùng tiêm. Vaccine của Moderna chính thức trở thành "ứng viên" đầu tiên tại Mỹ được bình duyệt.
Cuối tháng này, hãng dự kiến bắt đầu thử nghiệm giai đoạn ba, trước khi đệ trình lên các cơ quan có thẩm quyền để xin phê duyệt. Trong thông cáo báo chí, Moderna cho biết nếu vaccine tiếp tục chứng minh độ hiệu quả trong các thử nghiệm sắp tới, công ty đủ khả năng cung cấp khoảng 500 triệu liều mỗi năm và khoảng một tỷ liều kể từ năm 2021.
Tình nguyện viên tiêm thử vaccine tại Viện Nghiên cứu Kaiser Permanente Washington. Ảnh: NY Times
Theo Tiến sĩ Lisa Jackson, Viện Sức khỏe Kaiser Permanente Washington, mục tiêu của thử nghiệm giai đoạn một là kiểm tra độ an toàn và lượng kháng thể được sản sinh. Kết quả sơ bộ đã được công bố hồi tháng 5 năm nay.
"Phản ứng miễn dịch có vẻ khả quan, nhưng chúng tôi chưa rõ lượng kháng thể ngăn ngừa được virus trong bao lâu. Vì vậy, chúng tôi đang từng bước tiến đến các thử nghiệm có thể trả lời câu hỏi này", bà nói.
Moderna dự kiến tiến hành thử nghiệm quy mô lớn nhất vào ngày 27/7. Đây là đơn vị đầu tiên ở Mỹ tiến đến nghiên cứu giai đoạn ba. Các thử nghiệm mới đã cung cấp thông tin sơ bộ, có thể được sử dụng để xác định liều lượng vaccine trong các giai đoạn tiếp theo.
Theo Tiến sĩ Penny Heaton, giám đốc điều hành của Quỹ Bill & Melinda Gates, dữ liệu an toàn của thử nghiệm mới khá hứa hẹn, hỗ trợ công tác phát triển vaccine.
"Tuy nhiên, chúng ta cần lưu ý đây là quá trình phức tạp. Vẫn còn nhiều việc cần làm trước khi vaccine được phân phối rộng rãi", ông nói thêm.
Đến nay, Mỹ, châu Âu, Trung Quốc và Australia đang có 160 "ứng viên" tiềm năng ngừa nCoV, trong đó 20 loại đến giai đoạn thử nghiệm trên người. Gần 140 loại khác được đánh giá tiền lâm sàng, theo báo cáo ngày 6/7 của Tổ chức Y tế Thế giới (WHO).
Tháng 7 quyết định cuộc đua vaccine  Vào mùa hè, các nhà sản xuất tiến hành thử nghiệm vaccine ở giai đoạn cuối, quy mô rộng hơn để chứng minh hiệu quả của chúng. Các nhà khoa học tại Trung Quốc đã mở rộng phạm vi nghiên cứu ra ngoài lãnh thổ, tìm kiếm tình nguyện viên ở Brazil và các Tiểu vương quốc Arab thống nhất (UAE) do số...
Vào mùa hè, các nhà sản xuất tiến hành thử nghiệm vaccine ở giai đoạn cuối, quy mô rộng hơn để chứng minh hiệu quả của chúng. Các nhà khoa học tại Trung Quốc đã mở rộng phạm vi nghiên cứu ra ngoài lãnh thổ, tìm kiếm tình nguyện viên ở Brazil và các Tiểu vương quốc Arab thống nhất (UAE) do số...
 Thực hư tin Campuchia điều binh sĩ tới biên giới với Thái Lan sau vụ đối đầu08:43
Thực hư tin Campuchia điều binh sĩ tới biên giới với Thái Lan sau vụ đối đầu08:43 Đòn giáng của ông Trump vào Ukraine trước ngưỡng cửa đàm phán với Nga09:07
Đòn giáng của ông Trump vào Ukraine trước ngưỡng cửa đàm phán với Nga09:07 Xung đột Nga - Ukraine trước bước ngoặt08:59
Xung đột Nga - Ukraine trước bước ngoặt08:59 Vụ trộm bồn cầu làm bằng 98 kg vàng: nghi phạm ra tay trong 5 phút09:08
Vụ trộm bồn cầu làm bằng 98 kg vàng: nghi phạm ra tay trong 5 phút09:08 Báo Mỹ: Ông Trump "khó chịu" vì trang phục của ông Zelensky01:28
Báo Mỹ: Ông Trump "khó chịu" vì trang phục của ông Zelensky01:28 Lãnh đạo Mỹ - Ukraine khẩu chiến kịch liệt08:41
Lãnh đạo Mỹ - Ukraine khẩu chiến kịch liệt08:41 'Ông Trump rất thất vọng về ông Zelensky, muốn Ukraine thỏa thuận khoáng sản 500 tỉ USD'09:08
'Ông Trump rất thất vọng về ông Zelensky, muốn Ukraine thỏa thuận khoáng sản 500 tỉ USD'09:08 Ông Trump sẽ đích thân kiểm kê kho vàng trị giá 425 tỉ USD của Mỹ09:43
Ông Trump sẽ đích thân kiểm kê kho vàng trị giá 425 tỉ USD của Mỹ09:43 Ông Trump khen ông Zelensky dũng cảm, không cam kết hỗ trợ lực lượng châu Âu tại Ukraine08:00
Ông Trump khen ông Zelensky dũng cảm, không cam kết hỗ trợ lực lượng châu Âu tại Ukraine08:00 Phát sốt đoạn phim ông Trump, ông Netanyahu nhâm nhi cocktail ở bãi biển Gaza08:01
Phát sốt đoạn phim ông Trump, ông Netanyahu nhâm nhi cocktail ở bãi biển Gaza08:01 Không chỉ Mỹ, Pháp cũng đàm phán về khoáng sản quan trọng với Ukraine09:14
Không chỉ Mỹ, Pháp cũng đàm phán về khoáng sản quan trọng với Ukraine09:14Tiêu điểm
Tin đang nóng
Tin mới nhất

Mỹ thừa nhận xung đột Ukraine là cuộc chiến ủy nhiệm giữa hai cường quốc

Mỹ đẩy mạnh việc cắt giảm nhân sự

Brazil khẳng định cam kết thúc đẩy hợp tác đa phương về khí hậu

Các nhà sản xuất ô tô châu Âu bị cuốn vào cuộc chiến thương mại của Tổng thống Trump

Ngành khí đốt của Ukraine chịu đòn kép

Tổng thống Nga Putin bổ nhiệm Đại sứ mới tại Mỹ sau nhiều tháng 'trống ghế'

EU lên kế hoạch phát hành trái phiếu quân sự để tăng cường quốc phòng

Ukraine cảnh báo NATO chưa sẵn sàng cho chiến tranh hiện đại

Diện tích băng biển toàn cầu thấp kỷ lục vào tháng 2

Argentina tiếp tục đối mặt với sóng nhiệt

Canada đề xuất loại bỏ dần 'hóa chất vĩnh cửu' trong các sản phẩm tiêu dùng

Pháp đề xuất triển khai vũ khí hạt nhân để bảo vệ EU
Có thể bạn quan tâm

Alec Baldwin muốn tự tử sau vụ nổ súng chết người trên phim trường
Sao âu mỹ
21:08:51 06/03/2025
Chỉ trong 10s, hành động của bố chồng trước cửa phòng con dâu khiến 2 triệu người phải "vào cuộc"
Netizen
21:08:02 06/03/2025
Có một nghệ sĩ Quý Bình ưu tú đến thế: Không chỉ là diễn viên tài hoa, mà vai trò ca sĩ cũng đảm nhận xuất sắc
Nhạc việt
21:05:08 06/03/2025
Người phụ nữ bị gãy lún 3 mắt cá chân khi nhảy dây
Sức khỏe
20:58:06 06/03/2025
3 con giáp đỏ nhất cuối tháng 2 âm lịch, vận tài kim quý ngồi không cũng có tiền, đụng đâu thắng đó, chẳng bon chen vẫn giàu nứt vách
Trắc nghiệm
20:46:51 06/03/2025
Jennie ngầm thừa nhận mối quan hệ với nam thần đẹp nhất BTS đã kết thúc?
Nhạc quốc tế
20:42:51 06/03/2025
Vì sao NSND Tự Long từ chối Hòa Minzy?
Sao việt
20:14:27 06/03/2025
Hàng dài du khách xếp hàng, hào hứng được ghé thăm cặp gấu trúc song sinh siêu đáng yêu ở Hồng Kông (Trung Quốc)
Lạ vui
20:09:21 06/03/2025
Hot: Nữ diễn viên sống sót qua nhiều lần tự tử bất ngờ kết hôn với bạn thân 17 năm
Sao châu á
19:57:02 06/03/2025
Bộ phim nóng nhất sự nghiệp diễn viên Quý Bình vừa qua đời
Phim việt
18:45:54 06/03/2025
 Chủ tịch khóa 75 Đại hội đồng LHQ thảo luận với Nga về kế hoạch hành động tiếp theo
Chủ tịch khóa 75 Đại hội đồng LHQ thảo luận với Nga về kế hoạch hành động tiếp theo Biden liên tiếp tung ‘đòn phản công’ Trump
Biden liên tiếp tung ‘đòn phản công’ Trump

 Vaccine tiến đến giai đoạn thử nghiệm cuối cùng
Vaccine tiến đến giai đoạn thử nghiệm cuối cùng Công ty Mỹ bỏ thử nghiệm vaccine nCoV trên động vật
Công ty Mỹ bỏ thử nghiệm vaccine nCoV trên động vật Australia: Người hiến huyết tương cứu 2,4 triệu trẻ em qua đời ở tuổi 88
Australia: Người hiến huyết tương cứu 2,4 triệu trẻ em qua đời ở tuổi 88 Máy bay chiến đấu Hàn Quốc 'thả nhầm' bom khiến nhiều người dân bị thương
Máy bay chiến đấu Hàn Quốc 'thả nhầm' bom khiến nhiều người dân bị thương
 Khách mua kem hoảng hồn khi thấy rắn còn nguyên bên trong
Khách mua kem hoảng hồn khi thấy rắn còn nguyên bên trong Dân thường Ukraine mất hy vọng trước tin Mỹ cắt viện trợ quân sự
Dân thường Ukraine mất hy vọng trước tin Mỹ cắt viện trợ quân sự Bitcoin biến động như tàu lượn, chuyên gia cảnh báo
Bitcoin biến động như tàu lượn, chuyên gia cảnh báo
 Biểu tình rung chuyển thủ đô Hàn Quốc
Biểu tình rung chuyển thủ đô Hàn Quốc Nguyên nhân Quý Bình mắc bạo bệnh hơn 1 năm nhưng không cho người đến thăm
Nguyên nhân Quý Bình mắc bạo bệnh hơn 1 năm nhưng không cho người đến thăm Tình trạng khó hiểu của Quý Bình và vợ doanh nhân trước khi nam diễn viên qua đời
Tình trạng khó hiểu của Quý Bình và vợ doanh nhân trước khi nam diễn viên qua đời Thông tin tang lễ của diễn viên Quý Bình
Thông tin tang lễ của diễn viên Quý Bình Lộ hình ảnh hiếm lúc Quý Bình chữa trị u não, nói 1 câu xót xa: "Tôi hết cơ hội rồi"
Lộ hình ảnh hiếm lúc Quý Bình chữa trị u não, nói 1 câu xót xa: "Tôi hết cơ hội rồi" Trấn Thành - Ngọc Lan và cả showbiz đồng loạt tiếc thương trước sự ra đi của Quý Bình
Trấn Thành - Ngọc Lan và cả showbiz đồng loạt tiếc thương trước sự ra đi của Quý Bình Tin nhắn cuối cùng của Quý Bình trước khi ra đi: "Tất cả đã dừng lại với anh rồi em ạ"
Tin nhắn cuối cùng của Quý Bình trước khi ra đi: "Tất cả đã dừng lại với anh rồi em ạ"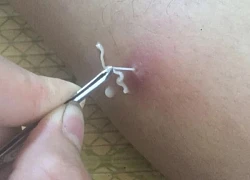 Cạy vảy vết thương ở đầu gối, người đàn ông ở Hòa Bình bất ngờ kéo ra được giun rồng dài 10cm
Cạy vảy vết thương ở đầu gối, người đàn ông ở Hòa Bình bất ngờ kéo ra được giun rồng dài 10cm Quý Bình trải qua những gì trong suốt 1 năm chiến đấu với bệnh u não?
Quý Bình trải qua những gì trong suốt 1 năm chiến đấu với bệnh u não? Bài đăng cuối cùng chỉ 2 từ gây nghẹn lòng của Quý Bình trước khi qua đời vì bạo bệnh
Bài đăng cuối cùng chỉ 2 từ gây nghẹn lòng của Quý Bình trước khi qua đời vì bạo bệnh Tiêu chí sáp nhập các tỉnh thành theo Kết luận 127 của Bộ Chính trị
Tiêu chí sáp nhập các tỉnh thành theo Kết luận 127 của Bộ Chính trị SỐC: Diễn viên Quý Bình qua đời ở tuổi 42
SỐC: Diễn viên Quý Bình qua đời ở tuổi 42 Bắt quả tang vợ đi nhà nghỉ với nhân tình ở Sơn La, anh chồng nói 1 câu khiến tất cả những người đang đánh ghen đều dừng tay
Bắt quả tang vợ đi nhà nghỉ với nhân tình ở Sơn La, anh chồng nói 1 câu khiến tất cả những người đang đánh ghen đều dừng tay Hòa Minzy công khai tin nhắn với NSƯT Xuân Hinh
Hòa Minzy công khai tin nhắn với NSƯT Xuân Hinh
 Học sinh giỏi quốc gia môn hóa điều chế ma túy được giảm án
Học sinh giỏi quốc gia môn hóa điều chế ma túy được giảm án Đạo diễn nói về chi tiết tranh luận của nghệ sĩ Xuân Hinh trong 'Bắc Bling'
Đạo diễn nói về chi tiết tranh luận của nghệ sĩ Xuân Hinh trong 'Bắc Bling'
 Chuyện gì đang xảy ra với Quán quân hot nhất Gương Mặt Thân Quen?
Chuyện gì đang xảy ra với Quán quân hot nhất Gương Mặt Thân Quen?